「皮膚」から作った卵子で不妊治療が変わる?
世界中で多くの人が「子どもを授かりたくても授かれない」という不妊症に悩んでいます。
その原因の一つは、卵子や精子がそもそも体内で作れない、または非常に少ないという問題です。
例えば女性の場合、卵子は生まれた時にすでに体内に数が決まっていて、新しく作られることはありません。
そして30代半ばを過ぎると、一般的に卵子の数はだんだん減っていき、その質(健康状態)も下がることが知られています。
そのため、一定の年齢を過ぎると自然な妊娠が難しくなり、体外受精(IVF)という方法に頼る人も増えます。
しかし体外受精でも、自分の卵子がもう使えない状態になってしまった場合、他の女性から健康な卵子を提供してもらわなければ子どもを持つことができません。
こうした問題を解決するために、科学者たちは長年にわたって新しい方法を模索してきました。
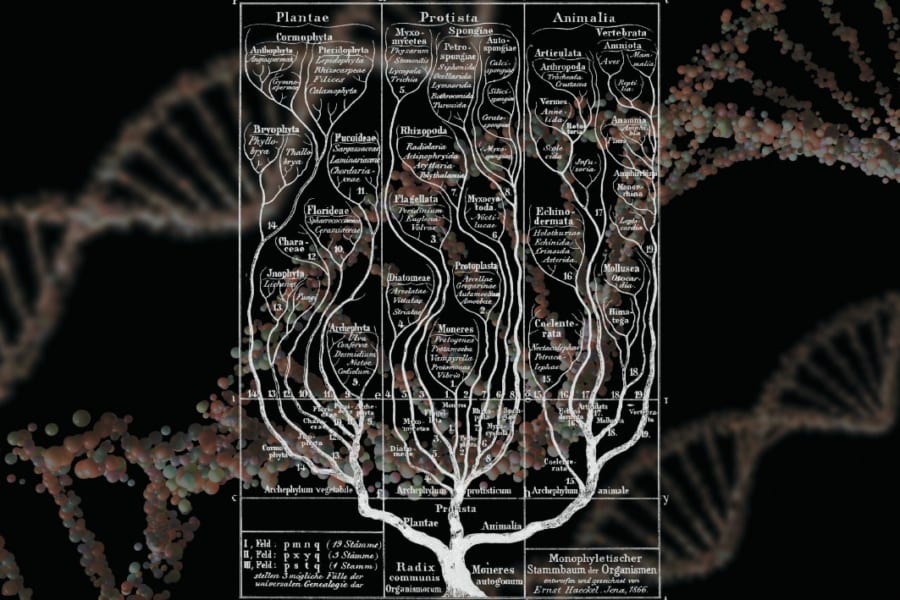
その中で特に注目されているのが、自分の皮膚細胞や血液細胞などの体の細胞から、卵子や精子を人工的に作り出す技術、「体外配偶子形成(IVG, in vitro gametogenesis)」です。
では、この「IVG」とは具体的にどのような技術なのでしょうか?
体内では、卵子や精子といった「配偶子(子どもを作るための細胞)」が作られるために、非常に特別な細胞分裂が起きます。
これを専門用語で「減数分裂」と呼び、通常の細胞分裂とは違って、染色体の数をちょうど半分にする特殊な仕組みです。
体の普通の細胞は染色体を父親と母親から1セットずつ受け継いでおり、「2セット(46本の染色体)」を持っています。
しかし、卵子や精子はその半分の「1セット(23本の染色体)」しか持っていません。
この減数分裂を再現することができれば、理論上はどんな細胞からでも卵子や精子を作り出すことが可能になります。
マウスではすでにこのIVGの技術によって、皮膚細胞などの体細胞から人工的に卵子を作ることに成功しています。
ところが人間の場合は話が大きく異なります。
人間の卵子は母親のお腹の中にいる胎児期に卵子の元となる細胞(始原生殖細胞)が作られ、出生後に思春期を迎えるまで、十数年間もかけてゆっくり成熟します。
この途方もなく長い時間は、研究室で再現するにはとても現実的ではありません。
研究者たちは、人間でもIVGを実現させるために、この長期間の過程を数週間ほどに短縮して再現できるような方法を求めていましたが、残念ながらそうした技術はまだ存在せず、IVGの実現にはまだ遠い道のりがあります。
ところが、もう一つのアプローチも考えられています。
それは、既に「体内で成熟した卵子」の力を借りて体細胞を「卵子に変身」させる方法です。
この技術の代表が、1997年にクローン羊「ドリー」を生み出したことでも知られる「体細胞核移植(SCNT)」という方法です。
そもそも私たちの体は、皮膚の細胞も脳の細胞も基本的には全く同じ設計図(遺伝情報)を持っています。
しかし、皮膚細胞は皮膚として、脳細胞は脳として機能するように、設計図の中でも特定のページだけを使いやすくしたり、逆に使いにくくしたりという調整が加えられています。
いったん皮膚細胞として設定された細胞を、ちょっとした刺激で卵子のような他の細胞に変えるのはとても難しいのです。
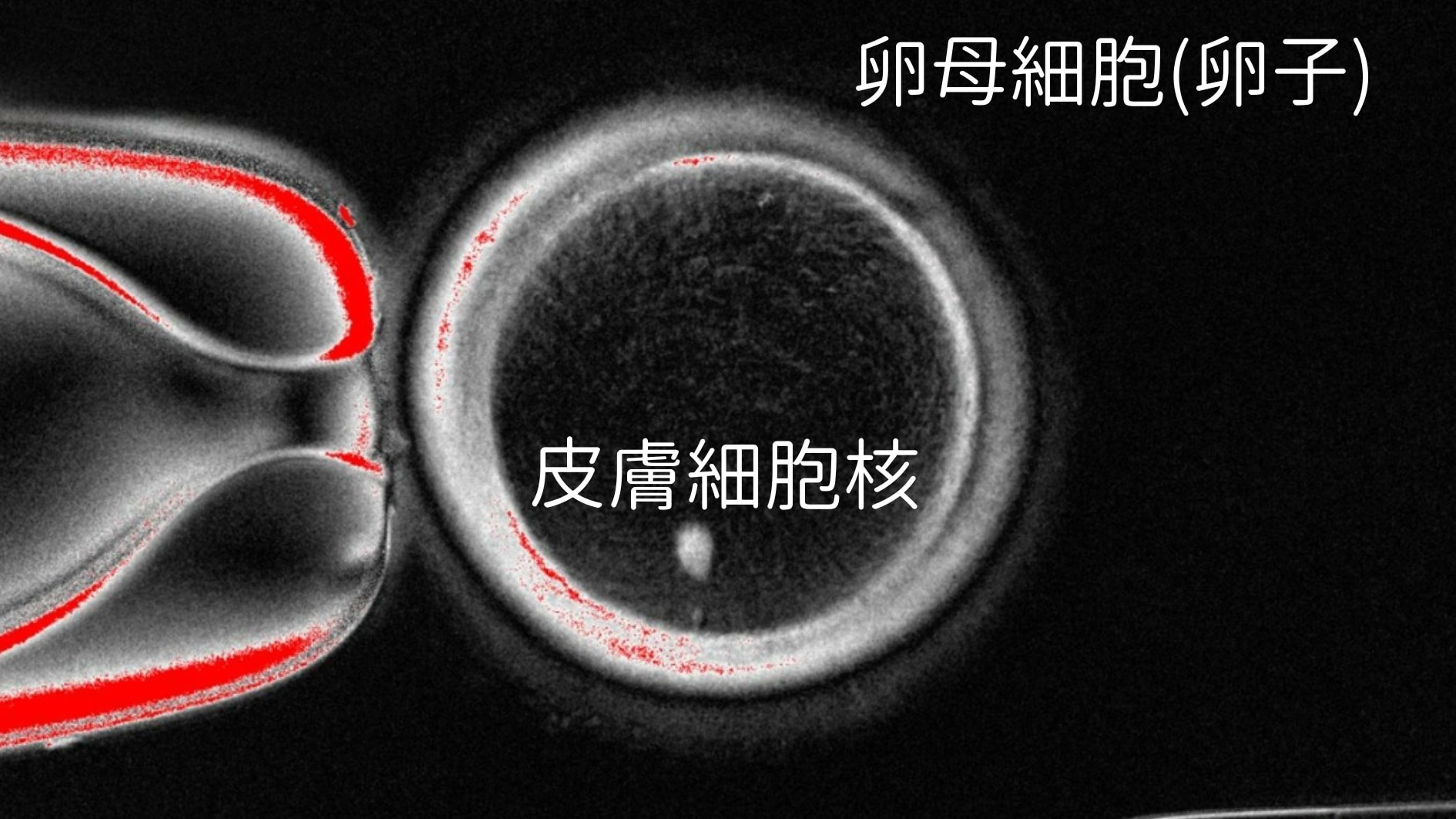
ところが、卵子の細胞質(細胞の核の周囲を満たす部分)には、非常に特殊な能力があります。
卵子の細胞質には、核の中の設計図をリセットし、細胞を再び卵子として一から作り直すことのできる不思議な力が備わっています。
そこで、卵子の核を取り除いて空にし、その卵子の細胞質の中に皮膚細胞の核を移植します。
こうすることで、皮膚細胞の核は一気に「卵子モード」にリセット(リプログラム)され、新たな卵子として再生されると期待されているのです。
しかし、ここにも大きな問題がありました。
私たちの皮膚細胞は、父親から受け継いだ染色体セット(23本)と母親から受け継いだ染色体セット(23本)の合計46本の染色体を持っています。
一方、普通の卵子は精子から染色体23本を受け取るため、自分自身の染色体を23本に減らしています。
もし皮膚細胞の核を移植しただけの卵子(SCNT卵子)が46本のままだと、そこに精子が持ち込む23本の染色体が加わり、合計69本(3セット)の染色体を持つ異常な受精卵(三倍体)が生まれてしまいます。
「2セットでも3セットでも、大差ないのでは?」と思うかもしれませんが、実はこれが生物の設計上とても大きな問題になるのです。
コラム:なぜ3セットはダメなのか?
生き物の設計図である染色体は、基本的に父親と母親から1セットずつ受け取り、合計2セットがペアになっています。「2セットでちょうど良いなら、3セットでも問題ないのでは?」と思われる方もいるかもしれません。
実はここが生物の不思議なところで、「3セット」は大きなトラブルを引き起こしてしまうのです。そもそも2セット(2倍体)の染色体がある状態でも、各遺伝子には父親と母親由来の「指示書」がそれぞれ存在しますが、通常これらは上手く連携をとり、状況に応じてどちらかが優先されるように細かく制御されています。
例えるなら、学校のクラスに委員長と副委員長が存在しており、お互いに補完し合っている状態と言えます。しかし染色体が3セット(三倍体)になると、この仕組みが一気に崩れてしまいます。3人目の委員長が突然出現し、内容も調整が取れずに、勝手にそれぞれの指示を出し始めるような状態です。
生徒たち(細胞)は、どの先生(遺伝子)の指示に従えばいいのか混乱し、まともな運営(正常な細胞活動)が成り立たなくなります。その結果、細胞は本来必要なタンパク質を作れなくなったり、逆に特定のタンパク質が過剰に作られてしまったりして、細胞としての機能が正常に保てなくなります。
実際、ヒトの場合に三倍体の受精卵が生じると、多くは初期の段階で発生が止まり、流産や死産という悲しい結果を引き起こします。つまり、染色体は単に数が多ければよいというわけではなく、「2セット」という絶妙なバランスこそが、生物の細胞がきちんと働くための大前提なのです。
こうした「3セット問題(69本の染色体)」を防ぐためには、皮膚細胞の染色体をあらかじめ半分に減らす必要があります。
本来の卵子は、精子を迎え入れる前に「減数分裂」という特別な分裂を行って染色体を半減(23本)させる仕組みを持っていますが、皮膚細胞のような体の細胞にはその機構がありません。
そこで研究チームは、核を除去した未受精卵(細胞質)に皮膚細胞の核を移植し、卵子が本来持っている染色体半減の働きを“借りる”という手法をとりました。
こうして生まれたのが、今回のキーワードとなる「ミトメイオーシス(mitomeiosis:体細胞分裂(mitosis)+減数分裂(meiosis)の造語)」です。
この工程を経ると、皮膚細胞由来の核は卵子の細胞質の中で、まるで卵子が行うように染色体を半分に減らし、残りを小さな細胞(極体)として捨てます。
こうして受精と補助活性化を経て、皮膚細胞由来の染色体が約半数(平均約23本)に減った状態の核が作られることが確認されました。
卵子の細胞質は、移植された皮膚細胞の核を初期化する「リセット装置」のような役割も果たし、核の状態を卵子に近づける力を持っています。
このため、移植した核の内部では卵子としての性質が徐々に進行していきます。
ただし、ここで重要な違いが見えてきました。
減数分裂では本来、対になった染色体同士が「組換え(クロスオーバー)」という遺伝情報のシャッフルを行ってから別れますが、今回の人工的な分裂では、この組換えがまったく起きていなかったのです。
つまり、今回の方法では46本の染色体をコイン投げのように半分ずつに分けただけで、遺伝情報をシャッフルせずに分配している状態です。
自然の卵子はこの「シャッフル」で遺伝子の多様性を確保していますが、人工卵子ではそれがありません。
それでも、予定どおり染色体数がほぼ半分になること自体は実現できたため、研究は次の段階に進みました。
次は、この人工卵子に顕微授精(ICSI)で精子を注入するステップです。
研究チームは実験全体で約82個の卵子を作製し受精させ、その結果を追跡しました。

正常に受精が進んだことを示す「前核」(受精後に現れる核)が確認できたのは、全体のうち約17%(ICSIのみ条件の平均)でした。
つまり、受精させた卵子の中でも、ごく一部だけが最初のステップを正しく踏み出せたことになります。
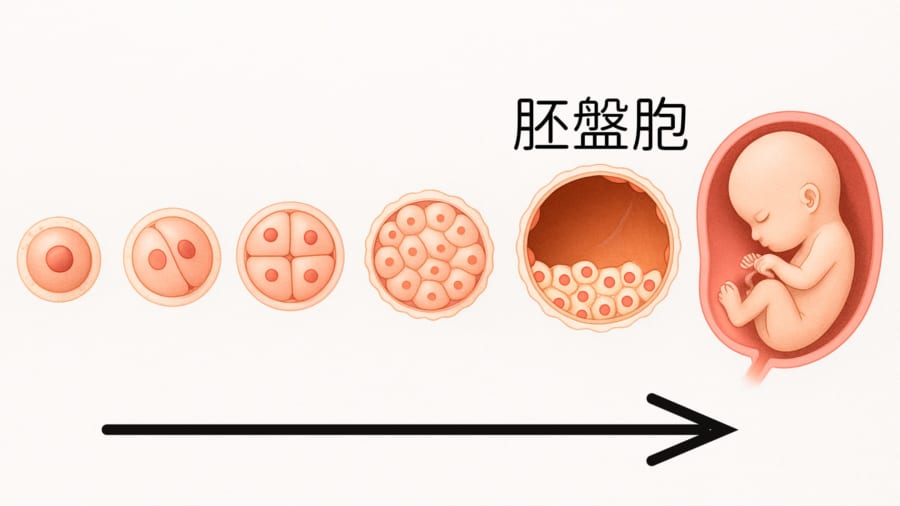
さらに追加培養を行うと、約9%(約7~8個)が胚盤胞の段階に成長したことがわかりました。
胚盤胞とは、受精後5〜6日目に見られる小さなシャボン玉のような構造で、内側には「内部細胞塊」という将来の胎児になる細胞の塊があり、その周囲を胎盤になる細胞が取り囲んでいます。
体外受精(IVF)などの不妊治療でも、この胚盤胞まで正常に成長できた胚は、その後の発育が順調な可能性が高いことが知られているため、重要なチェックポイントとされています。
今回の研究では倫理的配慮のため、この段階で培養を中止し、子宮への移植は行われませんでした。
さらに、この胚盤胞を詳しく分析したところ、皮膚細胞由来の染色体と精子由来の染色体が同じ細胞に統合されていることが確認されました。
ただし、個々の胚の中には細胞ごとに染色体構成が異なる「モザイク」状態のものもあり、完全に安定した遺伝構造を持つ胚はまだ少ないこともわかりました。





























![ラボン(Lavons) 柔軟剤 特大 シャイニームーン[フローラルグリーン] 詰め替え 3倍サイズ 1440ml](https://m.media-amazon.com/images/I/41ze0Blp9fL._SL500_.jpg)







![ニンテンドースイッチ2 / Nintendo Switch 2 専用 スヌーピー ケース (ブラック, ニンテンドースイッチ2専用) [並行輸入品]](https://m.media-amazon.com/images/I/31KV8sDIOWL._SL500_.jpg)