従来の周期表の限界
高電荷イオンとは、原子から多くの電子を剥ぎ取って非常に高い正電荷を帯びたイオンのことです。
例えばウランのように電子を何十個も持つ重い原子でも、極端に電離して残った電子がわずか数個になれば、それは高電荷イオンです。
高電荷イオンでは最も外側の電子殻がごっそり失われているため、通常の原子とは性質が大きく変わります。
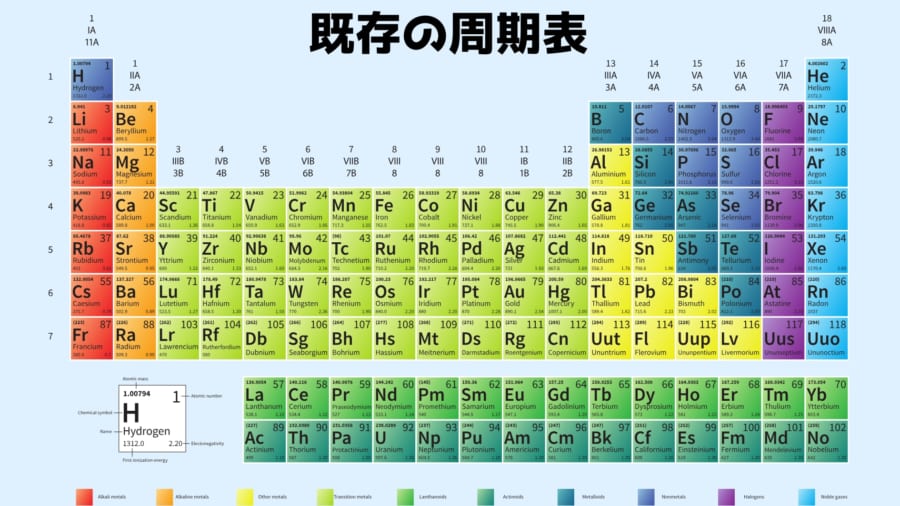
しかし私たちが慣れ親しんだメンデレーエフの周期表は、元素を原子番号(陽子の数)で分類しています。
そのためこのままでは、電子をほとんど失った高電荷イオンの電子的性質(電子配置やエネルギー準位の構造)をうまく記述できないのです。
実際、原子番号順の従来の表では、高電荷イオンにおけるエネルギーの性質が埋もれてしまい、発見が得られにくくなっていました。
そのため近年になって科学者たちは、「元素の並べ方を変えれば見える世界も変わるのではないか?」と考えるようになりました。
既存の周期表から原子の性質の多くが読み取られるように、新たな周期表が作られれば人類がこれまで知らなかった知識が得られる可能性があります。
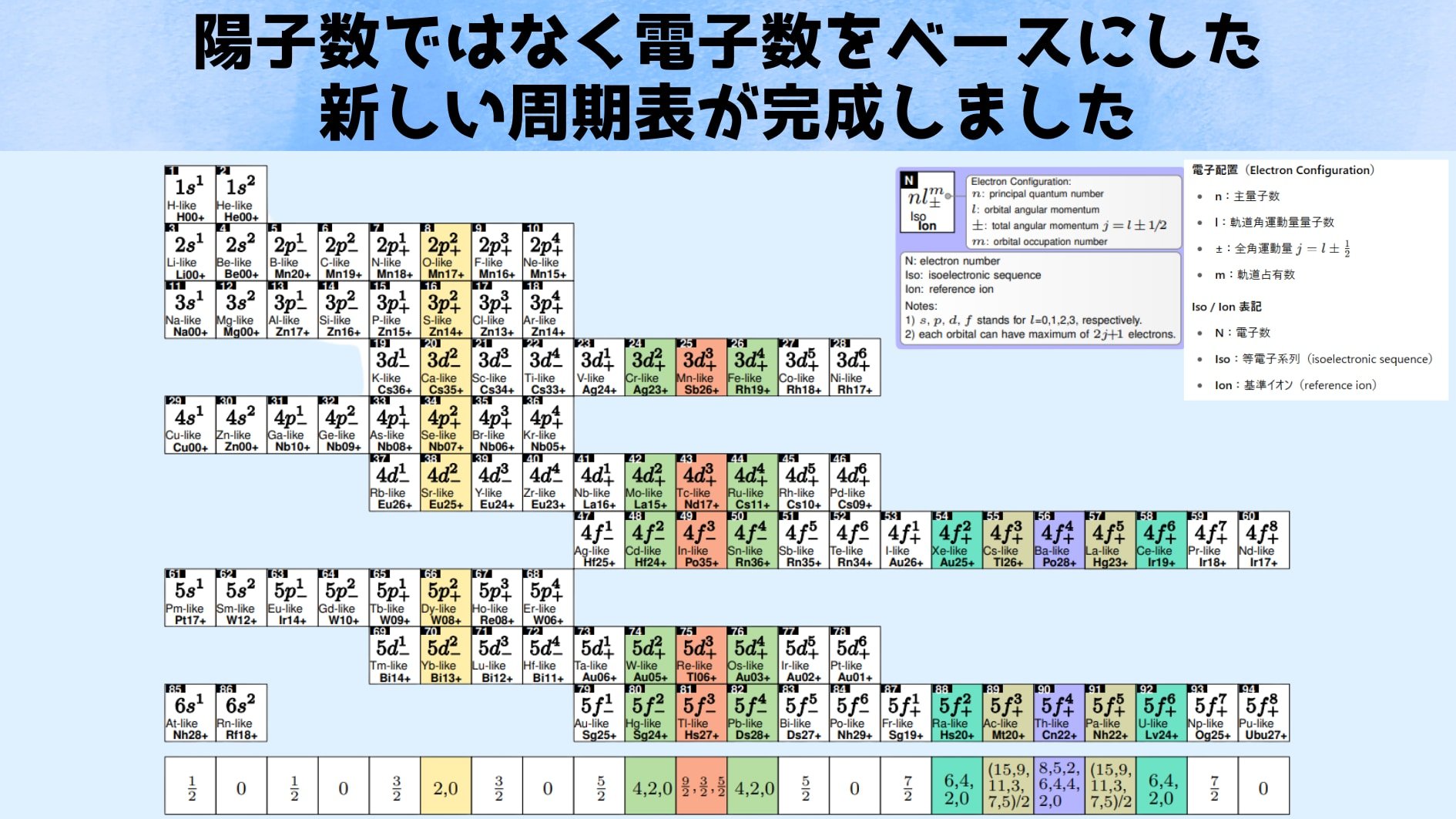
そこで生まれたのが、「残り電子数」に着目した新しい周期表です。
発表者の一人であるChunhai Lyu氏らは、電子が軌道に順々に収まっていく過程を基準に元素を並べ直しました。
言い換えれば、陽子の数ではなく電子の数で分類したのです。
これはちょうど、レゴブロックを一つずつ積み上げていくように原子を構築するイメージです。
1個の電子から始まり、2個、3個…と電子を追加してゆくと、電子配置ごとに特徴的な構造が現れます。
このように電子数に従って配置することで、異なる元素であっても等しい電子数を持つイオン同士(イソ電子系列と呼ばれます)が同じ列や行に並びます。
例えば「2個の電子を持つヘリウム」と「2個の電子を持つ炭素」は、ともに2という電子数で括られるといった具合です。
するとこの新しい「電子数を基準にした周期表」を使うと、いままで複雑で分かりにくかった高電荷イオン(電子を大量に失ったイオン)の性質が、意外にわかりやすいパターンとして見えてきました。
たとえるならば、難解な暗号が解けたように、高電荷イオンの「どんなエネルギー状態があるか」がスッキリ整理されるのです。
研究チームは、「この並べ方なら、高電荷イオンのエネルギーのしくみがぐっと単純化され、実験室のプラズマ研究や天体の観測データを読み解くのに役立つ」と話しています。
しかしより大きな発見は別にありました。





























![[WILL CLENS] シューズパウダー 日本製 無香料 シューケアキット 靴 消臭 パウダー (1本)](https://m.media-amazon.com/images/I/41m8Ig2XigL._SL500_.jpg)

![[W.P.S.] 防水スプレー 除菌 抗菌 防汚 機能付き 大容量420ml 日本製](https://m.media-amazon.com/images/I/41aHfy9uuZL._SL500_.jpg)
![よーく聞いてね!3つのヒントで学ぶ!どうぶつカード ([バラエティ])](https://m.media-amazon.com/images/I/51zT3OcliFL._SL500_.jpg)