炭素14の誕生と炭素放射年代測定の精度
炭素14は地球上では非常にまれな元素です。
炭素14は、上層大気内に含まれる窒素14が宇宙線を浴びて変異することで生まれています。
地球の大気の大部分は窒素であり、そのほぼ99%は窒素14です。
ここに宇宙から降り注ぐ高エネルギーの粒子(宇宙線)がぶつかることで、原子核内の陽子が中性子と置き換わり、窒素14が炭素14に変わるのです。
炭素14の化学的な性質は普通の炭素と変わらないので、酸素と結びつき二酸化炭素になることで、重くなって地上へ降りてきます。
そして、炭素14は植物が光合成をするために吸収され、その植物を動物が食べることで、生き物の中にも蓄積されていきます。
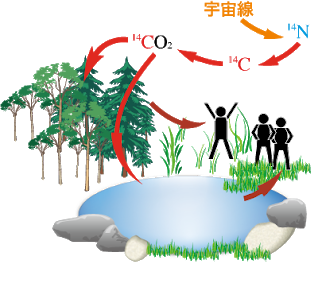
こうして炭素14は植物や動物の中に蓄積されます。
ただし炭素14が生成されるのは非常にまれな現象なので、その数は全炭素の内、約1兆分の1%しか存在しません。
さらに最初に説明した通り、炭素14は不安定な物質なので、最終的には放射性崩壊を起こして結局元の安定した窒素14に戻ってしまいます。
こうした流れを経て、物質中に残った僅かな炭素14の量を検出するのが、放射炭素年代測定です。
そのため、年代測定の精度はどれだけの数の炭素14をきちんと検出できたかという部分で決まってきます。
さきほど、半減期が炭素14の半分が崩壊する確率から決まっているといいましたが、この半減期は調べる元素の数が多ければ多いほど、ランダム性が減少して理論通りに変化することがわかっています。

これは同じ放射性元素の減少の様子を示したシミュレーションです。
上の数字が経過した時間で、左は4つしかサンプルとなる原子がない状態、右が原子が400個含まれる場合です。
ここからは、調べる原子の数が多いほど、全体的な崩壊の割合のランダム性が減っていることがわかります。
そのため、例えば炭素14を1万個計測できれば統計誤差は約80年、10 倍の10万個だとすると、約25年になったりするといいます。
このあたりの問題が年代測定の精度に関連してくるのです。
こうした方法で、炭素年代測定は物質の年代を特定しています。




























![[DABLOCKS] レザーケアセット 革靴 革ジャン 革製品 お手入れ](https://m.media-amazon.com/images/I/515FttM21TL._SL500_.jpg)
![[コロンブス] キレイな状態をキープ 長時間撥水 アメダス 防水・防汚スプレー420mL](https://m.media-amazon.com/images/I/31-OcmTs2LL._SL500_.jpg)
![シルバーバック【カンタン!たのしい!水の生きもの砂絵セット】 幼稚園 小学校 入園 入学 お祝い プレゼント 準備 ([バラエティ])](https://m.media-amazon.com/images/I/515gZ4F-QYL._SL500_.jpg)
![[WILL CLENS] シューズパウダー 日本製 無香料 シューケアキット 靴 消臭 パウダー (1本)](https://m.media-amazon.com/images/I/41m8Ig2XigL._SL500_.jpg)