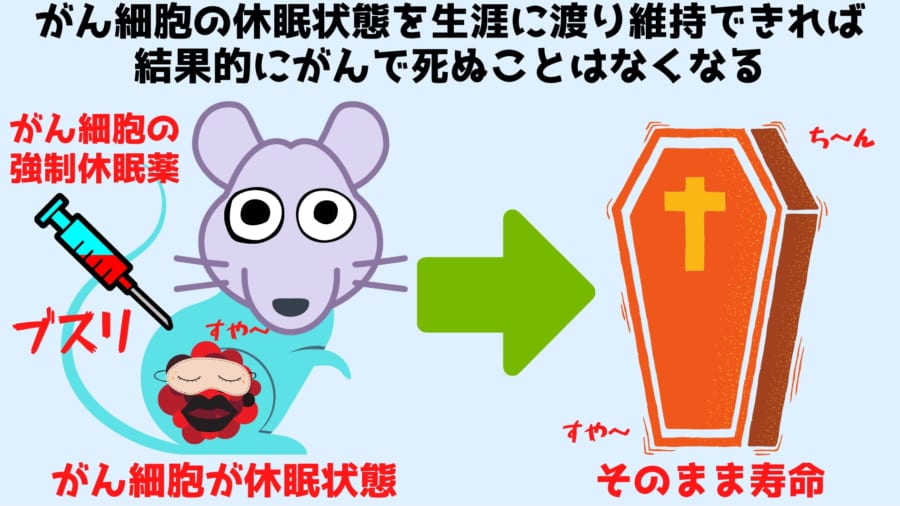
がん細胞を「強制的に眠らせる薬剤」を発見!
がん患者にとって、再発と転移は最も避けたいところです。
治療によって悪性腫瘍を小さくすることはできますが、時間が経過すると同じ場所で増殖したり、別の部位に転移して新たな腫瘍を作るからです。
しかも、再発したり新たに形成される二次腫瘍は、治療薬に対して耐性を身に着けることがあり、しばしば致命的な結果に結びつきます。
二次腫瘍ができる原因の1つとしてあげられるのが、がん細胞に備わった「休眠能力」です。
がん細胞には、自分を殺そうとする治療薬に接すると休眠状態に入ってやり過ごし、その間に治療薬に対する耐性を準備する能力があります。
そのため、再発と転移の防止が必要であり、がん細胞をいかにして殺し尽くすかが重要とされていました。
しかし今回、研究チームは発想の転換を行い、がん細胞に備わった休眠状態を積極的に引き起こす戦略を採用したのです。
がん細胞が休眠状態に入ると、多くの患者たちは一時的に症状が改善し、しばしば元の生活に戻ることもできます。
とすると、がん細胞の休眠状態を患者の一生よりも長く保つことができれば、理論的には、患者ががんで死ぬことはなくなります。
そこでチームは、患者から摘出したがん細胞(頭頸部扁平上皮癌:HNSCC)に対してさまざまな薬剤を与え、がん細胞を休眠させる効果があるかを1つ1つ地道に調べていきました。
(※正確には、がん細胞の休眠と深くかかわるNR2F1を活性化させる薬剤を探索しました)
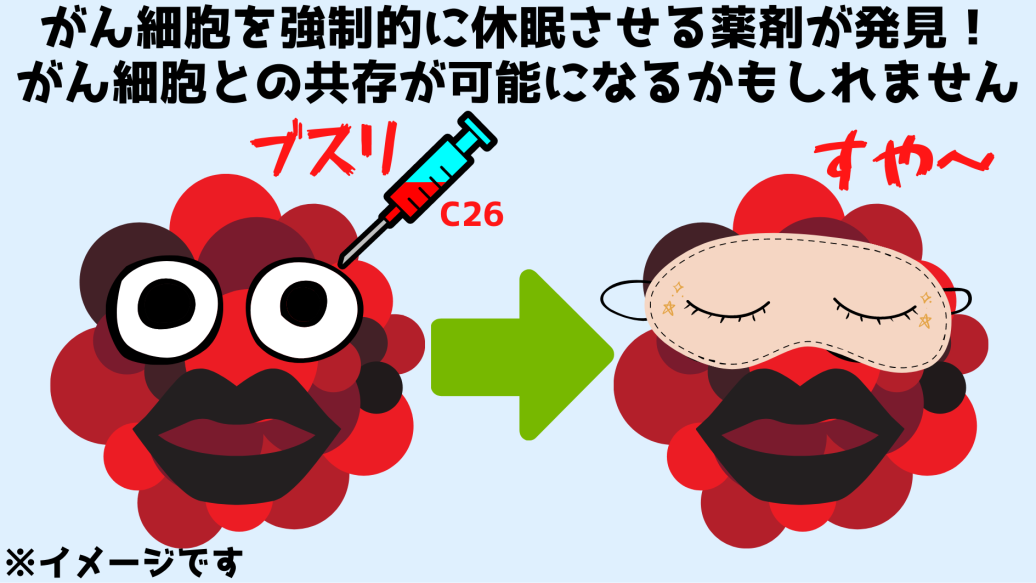
その結果、ChemBridge社から調達された「C26」と名付けられた小分子(C28H30N4OS)が、がん細胞の休眠を引き起こすNR2F1タンパク質を活性化させることが判明しました。
そこで次に「C26」が生物の体の中でも機能するかを、マウスを用いて確かめることに。
検証にあたってまず、人間のがん患者から摘出されたがん細胞(HNSCC)をマウスに注射し、がん状態にしました。
がん細胞が注射されたマウスでは通常、「手術できないがん(原発腫瘍)」に陥ります。
無理にHNSCCの腫瘍をマウスから取り除いた場合、肺全体に転移が起こってしまうからです(病巣となった肺を両方摘出すればマウスは死ぬ)。
しかし、HNSCCを注射されたマウスに「C26」を与えたところ、腫瘍が縮小している様子が確認されました。
また、手術を強行した後に「C26」を投与してみると、肺での転移性腫瘍の増殖が完全に阻止されたのです。
さらに、治療を中止した後も効果は継続し、がん細胞の増殖が抑え込まれていることが示されました。
この結果は「C26」が、がん細胞を強制的に「眠らせたままにする」ことで腫瘍を縮小させ、「手術できないがん」の手術を可能にし、危険な転移を完全に封じていることを示します。





























![よーく聞いてね!3つのヒントで学ぶ!どうぶつカード ([バラエティ])](https://m.media-amazon.com/images/I/51zT3OcliFL._SL500_.jpg)