がんリスクが80代で減少する理由
「幹細胞性の低下」と「鉄の利用能力低下」が、がんリスクの低下につながっているのか?
この疑問を解明するため、研究チームは遺伝子組み換えによってがんになりやすいマウスを作り、さらにマウスの肺でがん化を引き起こすウイルスを導入する実験を行いました。
具体的には、若いマウス(人間でいう20~30代相当)と高齢マウス(人間の70代後半~80代相当)の両方を比較することで、がん化の過程に違いがあるかどうかを調べたのです。
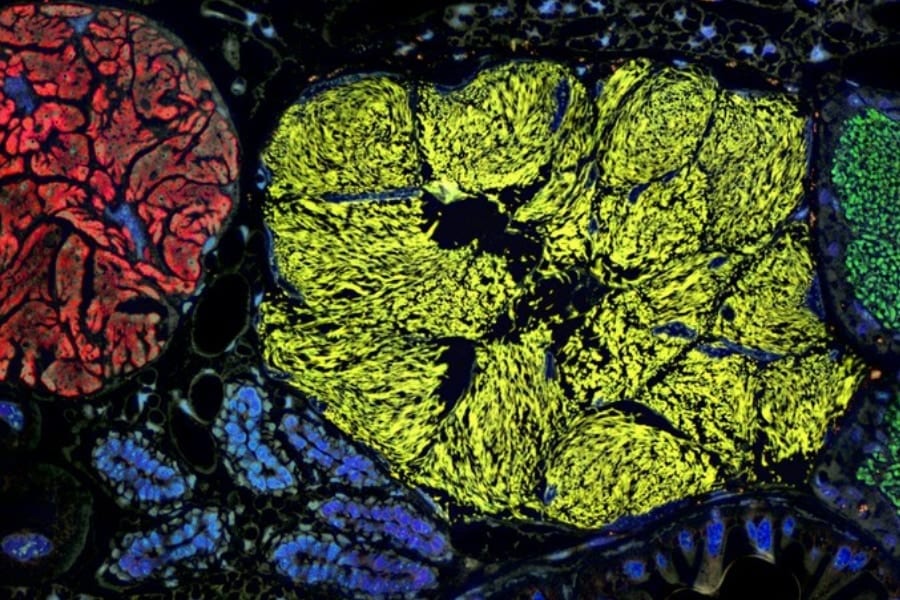
その結果、高齢マウスの肺細胞ではNUPR1という転写因子とリポカリン-2(LCN2)という鉄結合タンパクの発現が劇的に上昇し、それによって細胞の鉄の扱い方が変化し、がん化を抑える方向に働いていることが明らかになりました。
さらに、高齢マウスの細胞では、DNAメチル化などのエピジェネティックな修飾が変化して、これらNUPR1やリポカリン-2を抑えるタグが取り去られて(脱メチル化されて)いたことが分かりました。
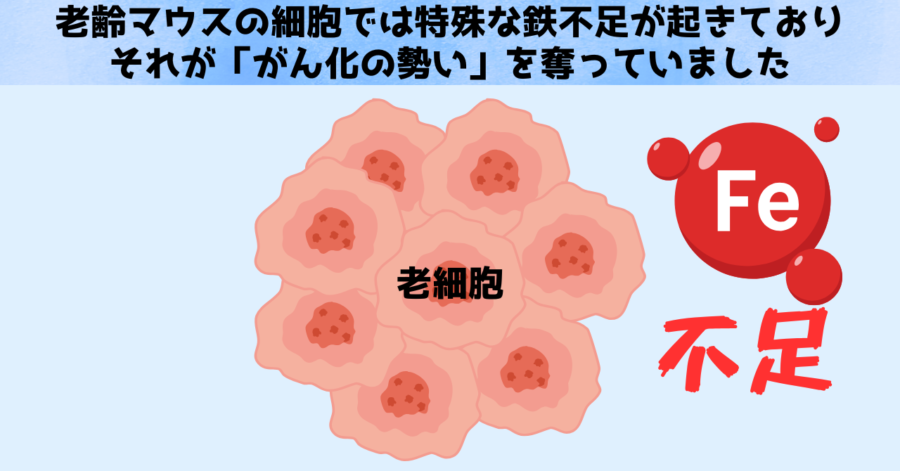
研究では、こうした遺伝子の活性化によって、細胞内部の自由な鉄が不足気味になり、細胞増殖や分化を支える仕組みが鈍化していたことがわかりました。
(※実際に、この高齢マウスの肺細胞に鉄を供給したところ、がん化が促進されるという結果も得られました。)
つまり、高齢マウスでは鉄を扱う遺伝子の発現様式が変わり、細胞内の鉄不足が引き起こされることで、幹細胞性が低下し、ひいてはがんリスクも抑えられている可能性があるわけです。
逆を言えば、若いマウスでは鉄を活用できる“元気”な幹細胞が存在し、そのためにがん化が急激に進む背景があると考えられます。
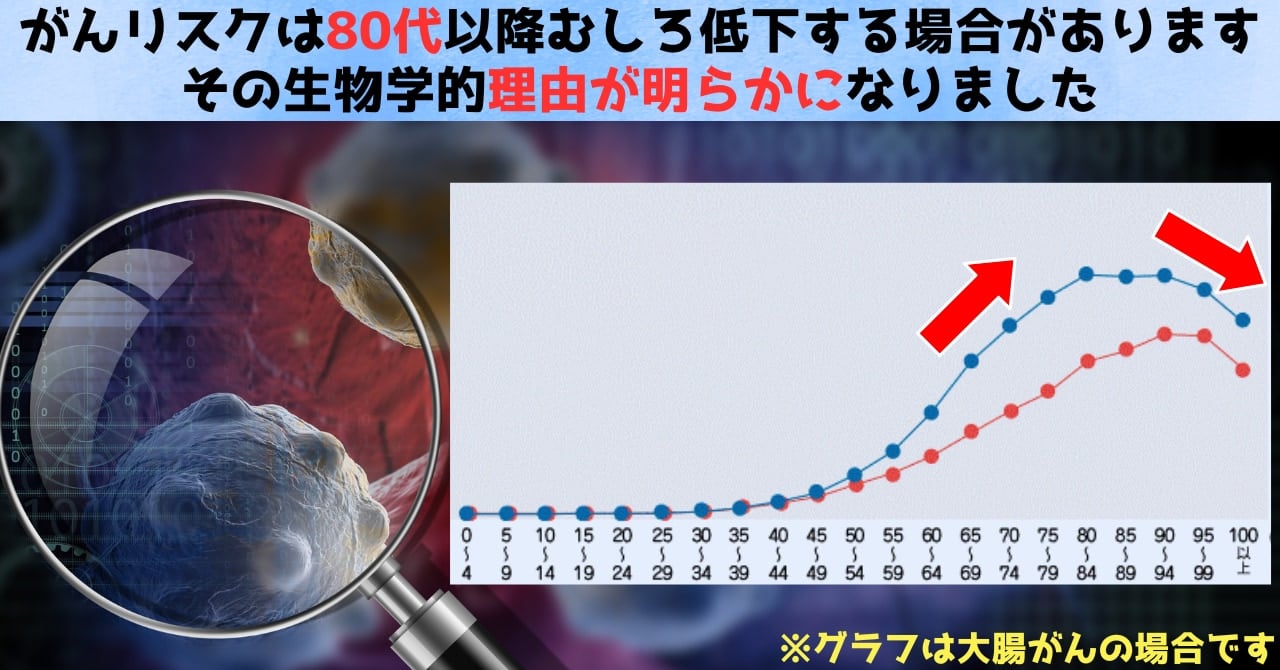
高齢者の場合、がんの進行がゆっくりになると言われていますが、いくつかのがんでは発生率そのものも低下しているのでしょう。
この結果は「高齢になればなるほどがんは増え続ける」という従来の常識に反するものであり、むしろ超高齢期には幹細胞性が弱まることでがん発生が抑制される、というメカニズムが具体的に提示された点で非常に画期的です。
特に「加齢でDNAメチル化が低下する=悪影響ばかり」という単純なイメージに対し、特定のエンハンサーでの脱メチル化がむしろ有利に働く場合もある、という点は重要です。
この新たな発見は、今後のがん予防や抗がん剤の開発において重要な役割を果たすでしょう。
たとえば、「若い世代で早期のがん芽を摘む戦略」 と 「高齢者での幹細胞性低下を加味した治療・ケアの最適化」 は、今後ますます注目されるはずです。
「がん細胞だけを狙うかたちで鉄不足を引き起こす」薬などを開発できれば、効果的ながん治療が実現するかもしれません。






























![シルバーバック かわいい海の生きもの CUBE 2X2 キューブ ツーバイツー|海の生き物デザイン 立体パズル スピードキューブ 5cm 子ども〜大人向け 知育 ギフトに最適 ([バラエティ])](https://m.media-amazon.com/images/I/41EJOOLgGXL._SL500_.jpg)
![よーく聞いてね!3つのヒントで学ぶ!どうぶつカード ([バラエティ])](https://m.media-amazon.com/images/I/51zT3OcliFL._SL500_.jpg)