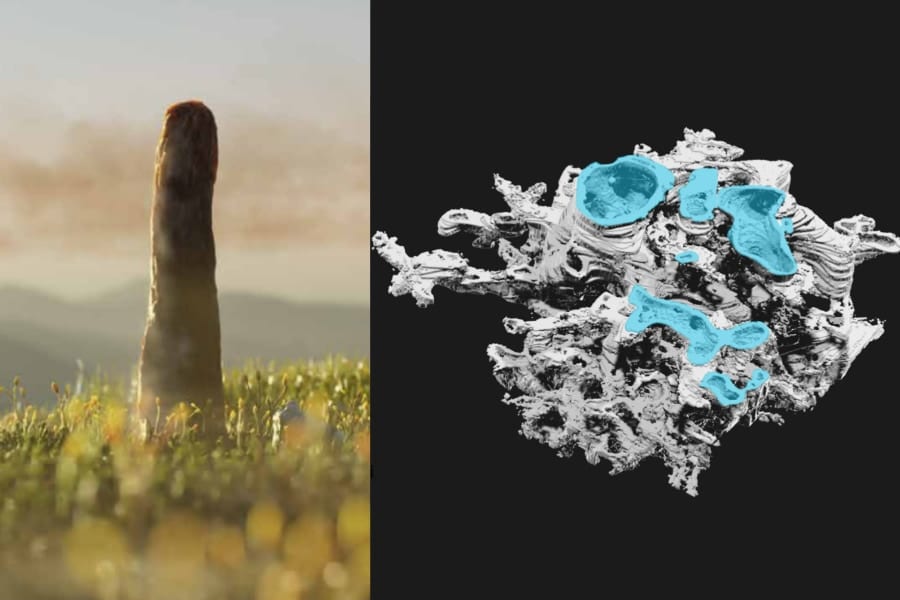
36時間の絶食で腸内環境はこう変わった
「腸内フローラのリセット&狙い撃ち給餌作戦」は本当にうまくのか?
答えを得るため研究者たちはまず、マウスの腸内細菌の変化を詳しく調べることにしました。
具体的には、健康なマウスをいくつかのグループに分け、それぞれ異なる条件を与えて、腸内環境がどのように変化するか観察しました。
あるグループのマウスには通常どおりのエサを与え、別のグループにはエサを全く与えずに36時間の断食をさせました。
さらに、断食させたグループの中でも、一部のマウスには断食の最中にMACs(腸内細菌利用糖)を与えました。
こうすることで、MACsが断食による腸内細菌の変化にどう影響するのかを確かめたのです。
実験を開始すると、まず「断食」そのものに驚くべき効果が現れました。
わずか36時間食事を止めただけで、マウスの腸内細菌の構成は劇的に変化したのです。
ただし、細菌の種類自体が減ったというよりは、もともと腸にいる細菌の割合が大きく変わりました。
これまで優勢だった細菌が激減し、一方で別の細菌が一気に勢力を広げる、まるで細菌同士の主導権争いが起きたような現象でした。
通常、腸内の細菌バランスは非常に安定していますが、断食という強烈なストレスによって、一時的にこのバランスがリセットされたような状態になったのです。
では、この「リセット状態」の腸にMACsを与えると何が起きるのでしょうか?
ここで研究チームは興味深い結果を発見しました。
実は断食直後の腸内細菌叢に与えるMACsの種類によって、増える細菌が全く違ったのです。
特にフラクトオリゴ糖(FOS)という種類のMACsでは、腸に良い影響をもたらすことで知られる「ラクトバチルス属(乳酸菌の一種)」が非常に顕著に増殖しました。
通常、FOSを与えるだけではラクトバチルス属はほとんど増えませんが、断食直後に与えると劇的な効果が出ました。
まるで荒れた土地(断食後の腸)に、乳酸菌が好む栄養を与えることで、一気に乳酸菌が元気に繁殖を始めるようなイメージです。
他にもガラクトオリゴ糖(GOS)やα-シクロデキストリン、さらにヒトの母乳に含まれるヒトミルクオリゴ糖(HMO)を与えると、それぞれ異なった細菌が増殖しました。
HMOを与えた場合には、乳酸菌だけでなくビフィズス菌に近いグループや、パラバクテロイデスという種類の細菌も増えました。
つまり、「どの細菌を増やしたいか」を決めて、それに最適なMACsを選ぶことによって、腸内の細菌叢をかなり精密に操作できる可能性が示されたのです。
さらに研究者たちが注目したのは、この作戦による腸の免疫機能への影響です。
腸の免疫を守る役割を持つIgAという抗体に着目して調べたところ、断食後にFOSを与えたマウスでは、糞便中のIgA量が通常のマウスに比べて約18倍という非常に高い値にまで上昇していました。
実はFOSとラクトバチルス属の組み合わせが腸のIgA産生を高めることは以前から知られていましたが、今回の研究では「断食後に与える」という新しいタイミングが、これまでにないほど強力にIgAを増やしたのです。
論文でも『FOSの摂取とラクトバチルス属の存在が腸管でのIgA産生の増強と関連する(FOS intake and the presence of Lactobacillus is associated with enhanced IgA production)』と報告されています。
これは、腸内の細菌の変化だけではなく、腸の免疫力そのものも短期間で大幅に改善できる可能性を示しています。






























![[WILL CLENS] シューズパウダー 日本製 無香料 シューケアキット 靴 消臭 パウダー (1本)](https://m.media-amazon.com/images/I/41m8Ig2XigL._SL500_.jpg)
![よーく聞いてね!3つのヒントで学ぶ!どうぶつカード ([バラエティ])](https://m.media-amazon.com/images/I/51zT3OcliFL._SL500_.jpg)
![[W.P.S.] 防水スプレー 除菌 抗菌 防汚 機能付き 大容量420ml 日本製](https://m.media-amazon.com/images/I/41aHfy9uuZL._SL500_.jpg)