2時間で腸が別人?脳が送り込む“瞬間指令”の正体
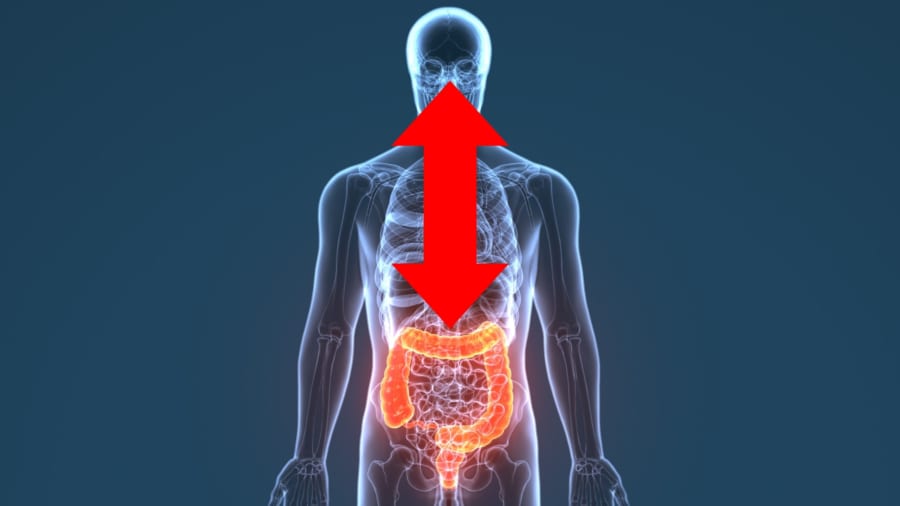
脳から腸へどうやって信号を送るのか?
研究者たちは最もダイレクトな方法をとりました。
脳の摂食行動を司る視床下部の神経細胞を人為的に操作して腸内細菌叢に何が起こるかを調べたのです。
より具体的には空腹感を引き起こす神経細胞(AgRPニューロン)と満腹感を伝える神経細胞(POMCニューロン)の活動を選択的に「スイッチのオン・オフ」し、その直後に腸内の細菌構成を分析したのです。
さらに、食欲や代謝を調節するホルモン(レプチンやグレリン)を脳内に投与する実験も組み合わせ、脳から腸への様々なシグナルが腸内細菌叢に与える影響を比較しました。
もし腸内細菌叢が脳の指令に反応するならば、これらのスイッチのオン・オフにも変化を現わすかもしれません。
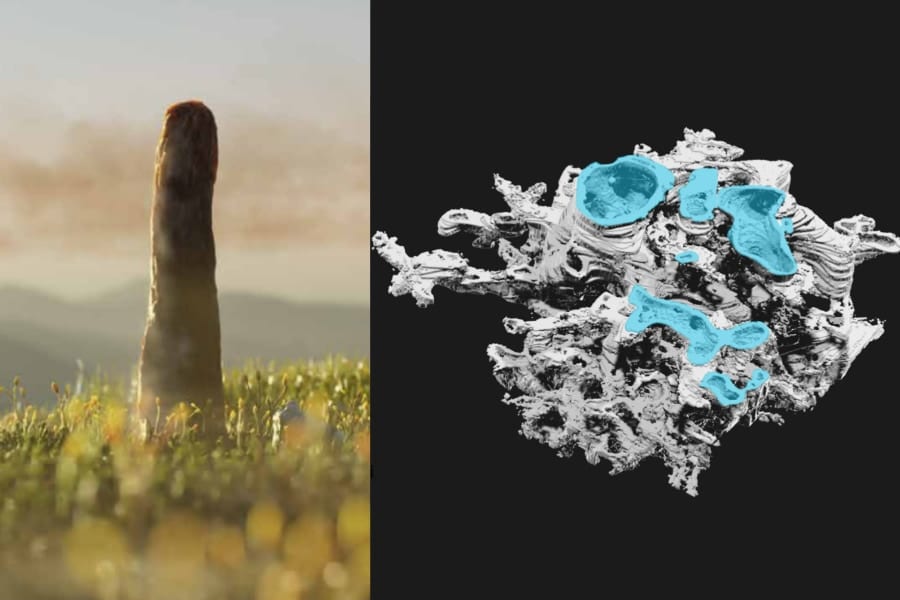
すると驚くべきことに、脳内のこれら「空腹スイッチ」や「満腹スイッチ」を入れると、わずか2~4時間という短時間でマウスの小腸内にいる特定の種類の細菌が増えたり減ったりする顕著なパターンが検出されたのです。
さらに興味深いことに、この脳による影響は腸の場所によって異なっており、活性化した神経の種類によって十二指腸や回腸など消化管の各部位で変化する細菌のグループが違っていました。
これは、脳がスイッチを切り替えるたびに腸内細菌叢の「地域構成」を選択的に作り替え、その結果として特定の細菌が増えやすく(あるいは減りやすく)なる条件が整えられる可能性を示しています。
また脳主導の腸内細菌叢の変化が起こる際、腸側の神経系にも変化が生じていることもわかりました。
具体的には、小腸(十二指腸)の神経ネットワークに再編成が見られ、ストレス時に働く交感神経(自律神経系の一部)の活動が高まっていたのです。
思ったよりも遥かに、脳と腸のやり取りは双方向かつドラマチックだったわけです。
次に、脳に満腹ホルモンであるレプチンを投与する実験でも同様の効果が確認されました。
通常、レプチンが脳に届くと食欲抑制などの作用が起こりますが、このホルモン刺激だけで腸内細菌叢に急速な変化が引き起こされたのです。
しかし、同じレプチン投与を行っても肥満状態のマウスでは腸内細菌叢に変化が起こりませんでした。
肥満マウスは慢性的にレプチン値が高いため脳がレプチンの信号に鈍感になっており、この「脳から腸への通信」が遮断されてしまうと考えられます。
実際、本研究でも肥満マウスではレプチン投与による交感神経の活性化が見られず、脳が腸内細菌叢を制御する能力が低下していました。
これは、肥満になると腸内細菌叢のバランスが乱れがちになる現象の一因として、脳からの調節シグナルの途絶が関与している可能性を示唆するものです。
























![[WILL CLENS] シューズパウダー 日本製 無香料 シューケアキット 靴 消臭 パウダー (1本)](https://m.media-amazon.com/images/I/41m8Ig2XigL._SL500_.jpg)


![よーく聞いてね!3つのヒントで学ぶ!どうぶつカード ([バラエティ])](https://m.media-amazon.com/images/I/51zT3OcliFL._SL500_.jpg)
![[W.P.S.] 防水スプレー 除菌 抗菌 防汚 機能付き 大容量420ml 日本製](https://m.media-amazon.com/images/I/41aHfy9uuZL._SL500_.jpg)