炭素はなぜ特別なのか?
すべての元素の中でも炭素は非常に特別な存在です。
これは炭素が多くの原子たちの中で、共有結合するために丁度いい位置にあるためです。
原子は最外殻に余っている電子の数によって、さまざまな電気的結合をして物質を生み出しています。
元素周期表はこの電子の数(正確には原子核内の陽子の数)が基準になって作られています。原子は電子を収納するための電子殻を持ち、電子の数が増えて1つの電子殻が埋まると、外側に新しい殻を作ってそこを埋めていきます。
原子としては、外側の電子殻が電子で埋まっている状態がもっとも安定している状態です。
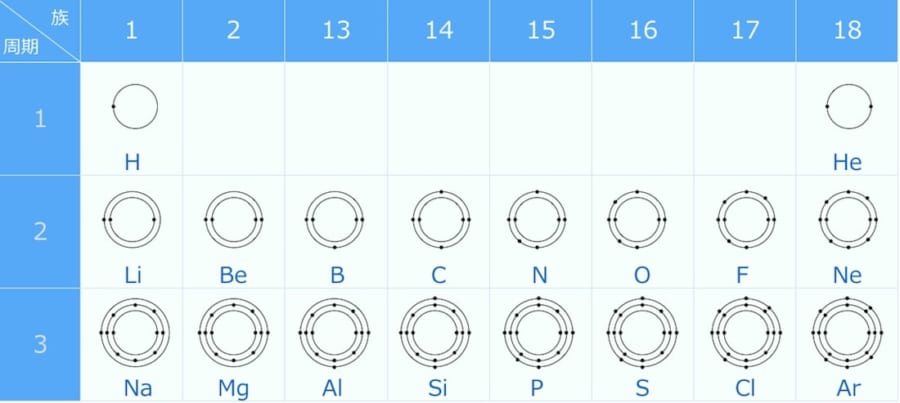
元素周期表とそれぞれの原子の電子配置を見てみましょう。
電子殻は二段目では2つですが、三段目では3つになっています。電子は原子核に引きつけられているため、新たな電子殻が増えて外側へ行くほど、互いの引きつける力が弱くなります。
このため、化学的な結合は元素周期表の上の段の原子ほど強くなります。このため炭素を含む2段目の原子たちは、比較的結合する力が強い原子ということになります。
さらに元素周期表では、右に行くほど電子を捕まえる力が強くなります。
この理由も、周期表の電子の配置を見ると理解できます。周期表で一番左にあるナトリウム(Na)を見てみましょう。
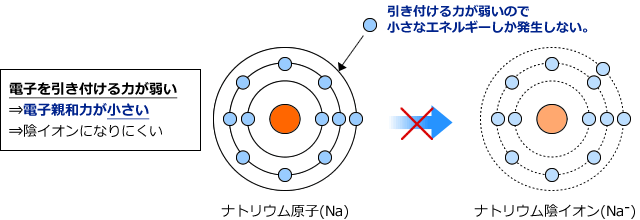
最外殻に電子が1つしかないナトリウム原子は、新しく電子を捕まえるより、余った電子を捨ててしまった方が安定します。
このため新たな電子を引きつける力より、手放す力の方が強く働きます。
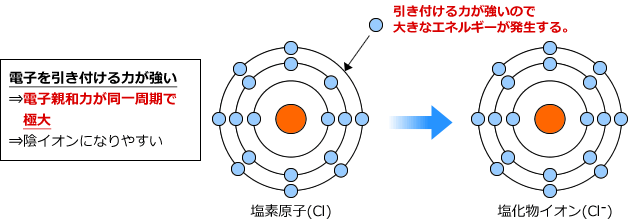
逆に周期表の右にある塩素(Cl)を見てみると、最外殻はほとんど電子で埋まっていて、1つだけ電子が足りない状態です。
つまり電子を手放すより、1つ電子を捕まえてきた方が安定するわけです。
ちなみに周期表の一番右側のネオン(Ne)などは、最外殻がすべて電子で埋まっていて余っても不足してもいないので、ほとんど化学反応しません。そのため、この話からは除外されます。
というわけで、改めて周期表を見てみると、電子を引きつけて結合する力が強いのはフッ素(F)ということになります。
しかしフッ素は電子を共有する枠が1つしかありません。手前の酸素(O)は2つ、その手前の窒素(N)は3つです。そして炭素(C)は4つあります。
これより手前のホウ素(B)は電子を捨てる力の方が強くなってしまいます。
というわけで、あらゆる原子の中で、炭素がもっとも多くの電子を安定して共有できる位置にいるのです。
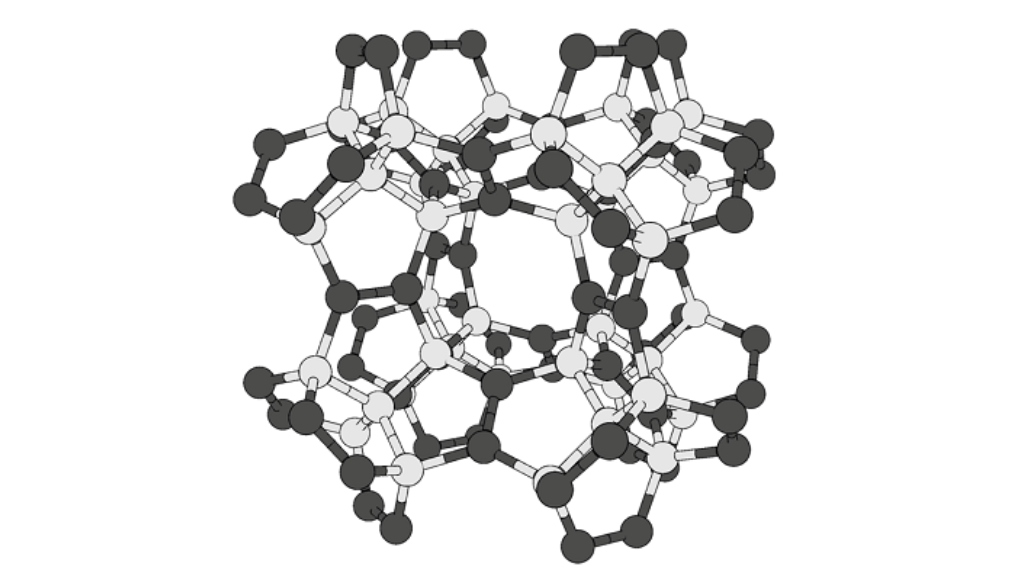
さらに炭素は同じ炭素同士で結合することが可能です。炭素同士がすべて共有結合という強い結合で結びついた状態がダイヤモンドです。
このため、ダイヤモンドは自然界の中でも格段に硬く強い物質なのです。





















![[WILL CLENS] シューズパウダー 日本製 無香料 シューケアキット 靴 消臭 パウダー (1本)](https://m.media-amazon.com/images/I/41m8Ig2XigL._SL500_.jpg)

![[W.P.S.] 防水スプレー 除菌 抗菌 防汚 機能付き 大容量420ml 日本製](https://m.media-amazon.com/images/I/41aHfy9uuZL._SL500_.jpg)
![よーく聞いてね!3つのヒントで学ぶ!どうぶつカード ([バラエティ])](https://m.media-amazon.com/images/I/51zT3OcliFL._SL500_.jpg)