電子1個の共有結合
中学の理科では化学結合の一種である共有結合について学びます。
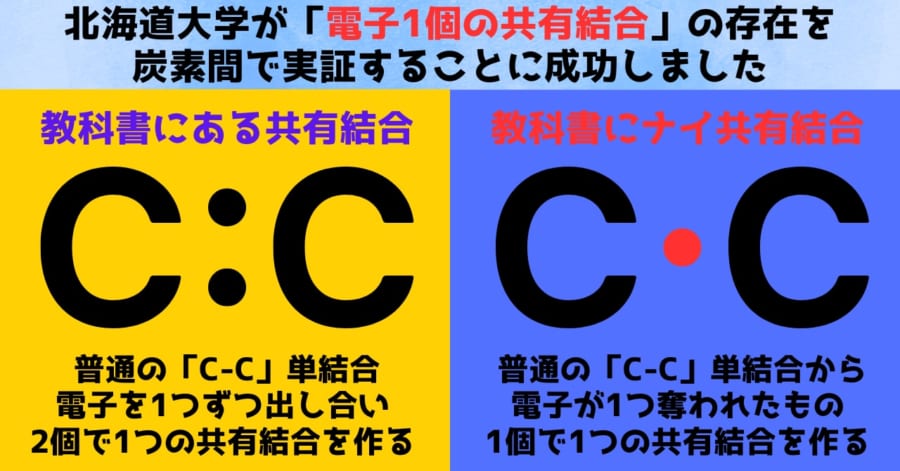
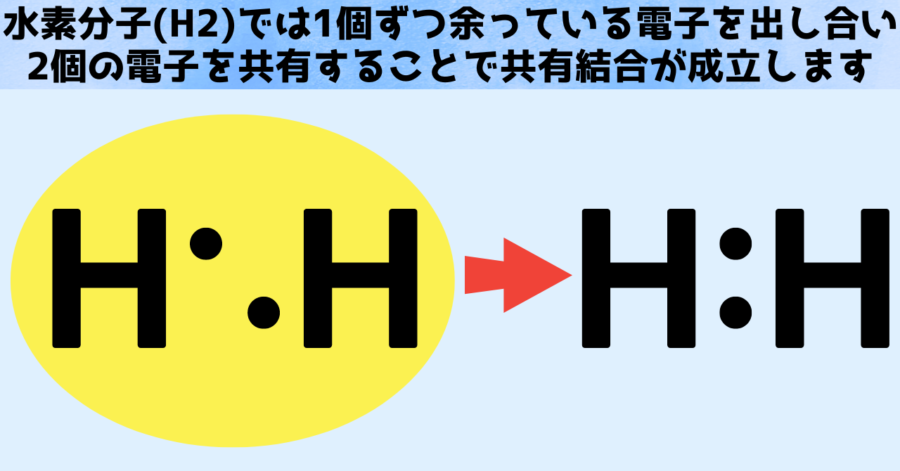
たとえば水素の場合、2つの水素原子がそれぞれの電子を1個ずつ出し合い「2個で1セット」となる共有結合を作ることが知られています。
このときの様子を教科書では「H:H」と表します。
点「・」は電子を現わし、2つのHの間で2個の電子が共有されて結合を起こしていることを示しています。
より簡略化バージョンでは2つの点の部分を棒で表し「H-H」と記述することもあります。
中学時代に「電子2個で腕1本」と覚えた人も多いでしょう。
この状態になると水素原子から水素分子に変化し、私たちがH2と呼ぶ馴染みのある状態になります。
一方、炭素の場合は余っている電子が周囲に4個存在しており、炭素を現わす「C」の周りには4個の点「・」が配置されています。
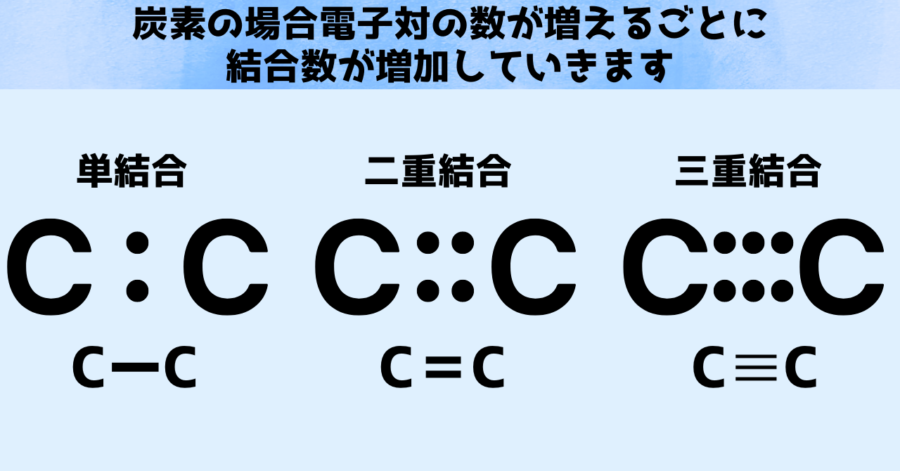
そのため炭素同士が共有結合する場合には、電子対が2つ(電子4個)の二重結合や、電子対が3つ(電子6個)の三重結合などを作ることができます。
有機分子などで炭素が「骨格」と言われているのは、炭素が4対という多数の結合を作れるからだと言えます。
温室効果ガスの代表例として知られる二酸化炭素(CO2)では炭素Cを中心にして左右で酸素Oとの二重共有結合が起きており「O::C::O」あるいは「O=C=O」の状態で存在します。
このように共有結合とは原子と原子の間に「2個で1セット」となる電子の対を作ることで形成されます。
しかし今からおよそ100年前の1931年、ノーベル化学賞受賞者であるポーリングは電子2個ではなく電子1個の共有結合「1電子結合」の概念を提唱しました。
実際、プラスに帯電したH 2 •+(カチオンラジカル)では、水素分子「H:H」から間にある電子が1つ取り除かれていると考えられています。
他にもいくつかの先進的な研究では電子1個の共有結合について同定したとの報告がなされています。
しかし1電子結合は非常に弱い結合であり、それだけを集めて単離することはかなり困難でした。
特に炭素同士の間での1電子結合については結晶学的な証拠が全くありません。
しかし今回、北海道大学の研究者たちは、あえてその困難に挑みました。
研究者たちはどうやって炭素間の1電子結合をみつけたのでしょうか?




























![[W.P.S.] 防水スプレー 除菌 抗菌 防汚 機能付き 大容量420ml 日本製](https://m.media-amazon.com/images/I/41aHfy9uuZL._SL500_.jpg)

![[WILL CLENS] シューズパウダー 日本製 無香料 シューケアキット 靴 消臭 パウダー (1本)](https://m.media-amazon.com/images/I/41m8Ig2XigL._SL500_.jpg)
![よーく聞いてね!3つのヒントで学ぶ!どうぶつカード ([バラエティ])](https://m.media-amazon.com/images/I/51zT3OcliFL._SL500_.jpg)


























