電子1個の共有結合は結合距離が異常に長かった
どうやって電子1個の共有結合(1電子結合)をみつけたのか?
研究者たちはまず観測に使用する化合物にこだわりました。
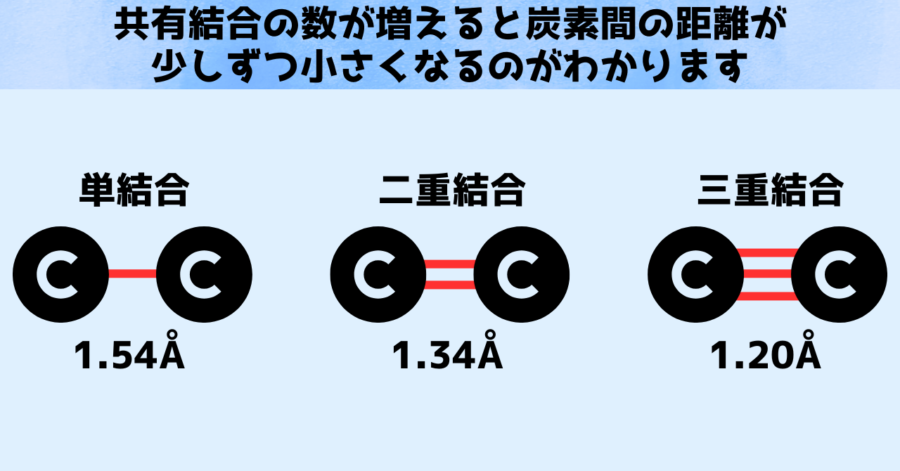
共有結合に使用される電子が増えて、単結合(電子2個)、二重結合(電子4個)、三重結合(電子6個)となると、炭素間の距離が1.54Å、1.34Å、1.20Åと縮まることが知られています。
そのため、逆に、もし電子1個しかない炭素間の結合を観測したい場合は、炭素間の距離が通常の単結合より長くなる材料を使用すれば、成功率が上がる見込みがありました。
北海道大学では以前の研究で、世界最長の炭素間結合を創出することに成功しています。
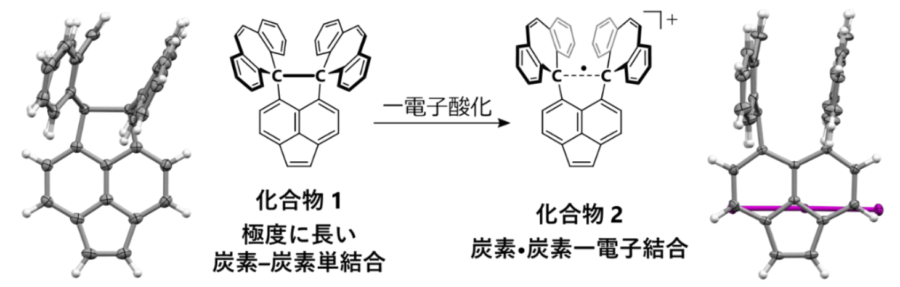
通常の炭素‐炭素の単結合の長さは1.54Åという決まった値をとります。
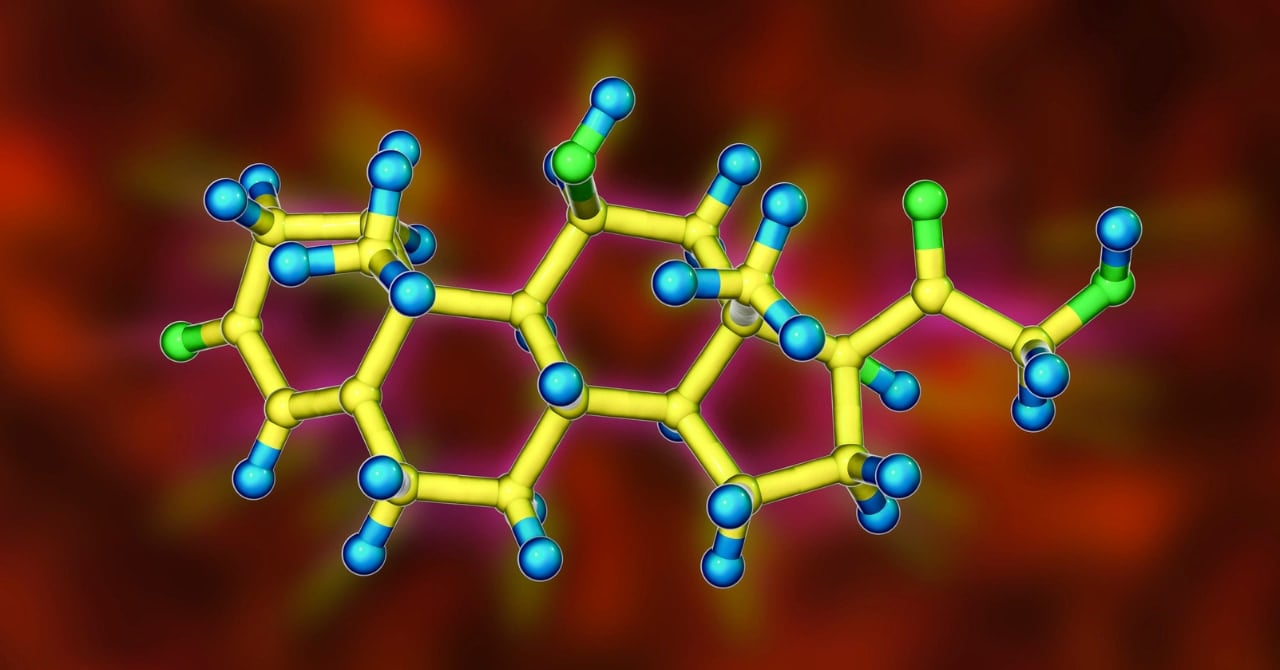
しかし研究者たちは中央の炭素間結合を強固なシェルで保護する「化合物1(HPE1)」を作ることで、この値を最大で1.806Åまで伸ばすことに成功していました。
化合物1は両側に存在する大きなシェルの立体的な障害のお陰で、中央部の炭素結合の距離が伸びがちになっていたのです。
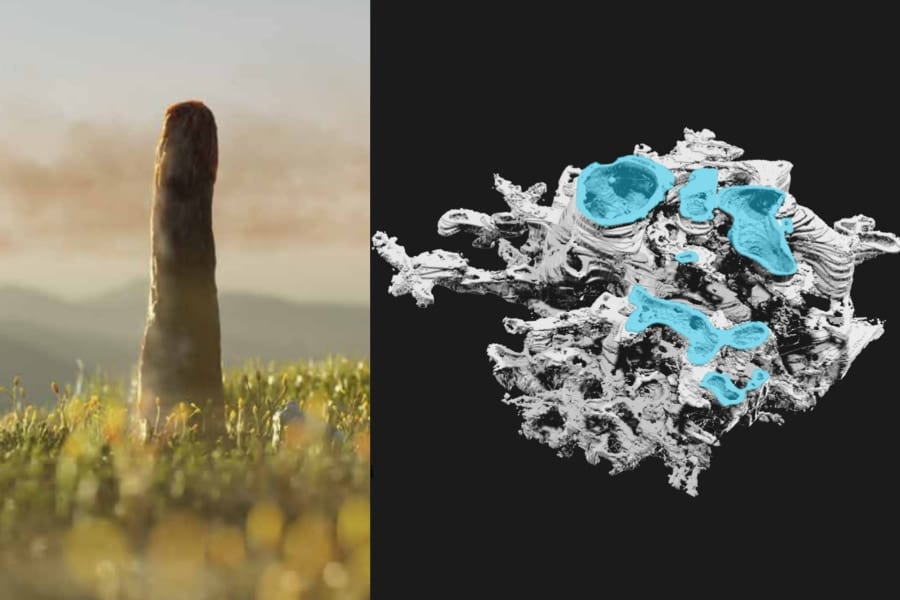
そこで今回の研究ではこの化合物1に対して1電子酸化を行い、電子を1つ取り除き化合物2を作成し、X線結晶構造解析を行いました。
X線結晶構造解析とは、分子が三次元的に規則正しく並んだ結晶に対してX線を照射し、その飛び散り方(回折像)から結晶中の電子分布を調べる技術です。
通常は電子分布から結晶内の原子の配置を決定しますが、今回は電子分布そのものに着目されました。
すると驚くべきことに、化合物2の中央の炭素間の結合長が2.921Åに達しており、さらにその間には結合電子が存在することが明らかになりました。
2.921Åというと単結合の2倍近い結合長になります。
結合が異常に長い化合物2では電子が2個未満、つまり1個で共有結合を形成していることを意味します。
またラマン分光法などを用いて、炭素間の電子密度を分析したところ、炭素間には電子が1個あるとする結果が得られました。
以上の結果から研究者たちは、化合物2の炭素間共有結合は電子1個で構成されていると結論しました。
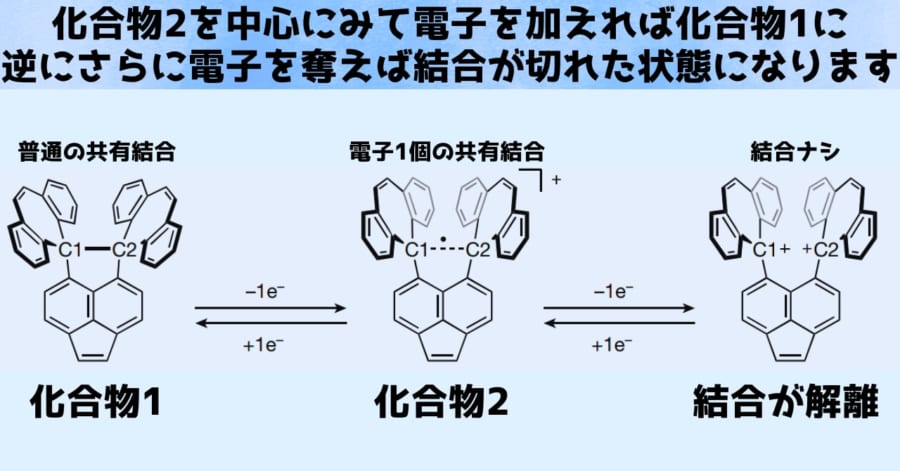
さらに化合物2に対して逆に電子1個を与えてみたところ、化合物1の状態に復元されることが示されました。
逆に化合物2から電子をさらに1個奪った場合には、炭素間結合が解離することも示されました。
このことは3つの状態を電子の出入りによって行き来させられることを示しています。



























![[W.P.S.] 防水スプレー 除菌 抗菌 防汚 機能付き 大容量420ml 日本製](https://m.media-amazon.com/images/I/41aHfy9uuZL._SL500_.jpg)

![[WILL CLENS] シューズパウダー 日本製 無香料 シューケアキット 靴 消臭 パウダー (1本)](https://m.media-amazon.com/images/I/41m8Ig2XigL._SL500_.jpg)
![よーく聞いてね!3つのヒントで学ぶ!どうぶつカード ([バラエティ])](https://m.media-amazon.com/images/I/51zT3OcliFL._SL500_.jpg)