原子の中はどうなっているの?
19世紀の終わりから20世紀の初め、光量子の問題と共に、もう1つ物理学界を揺さぶっていた問題があります。
それが原子の中はどうなっているのか? という問題です。
これは、レントゲンのX線発見の報告を発端に物理学の重要なテーマになっていきます。
この分野で目覚ましい活躍をした物理学者の一人が、アーネスト・ラザフォードです。

ラザフォードは、アルファ線、ベータ線(当時はウラン線と呼んでいた)の発見をはじめ、助手のガイガーと共に放射性崩壊による元素変換を発見してノーベル化学賞を受賞するなど、目覚ましい成果をあげます。
彼の功績はまだ原子の存在自体を疑問視する物理学者が多かった時代に、原子の実存性を決定付けるものでした。
そんなラザフォードとガイガーは、アルファ粒子の正体がなんであるかを研究しているとき、金箔にぶつけたアルファ粒子がたまにあり得ない方向へ散乱することに気づきます。
さらに研究をすすめると、あろうことか跳ね返ってくる粒子があることも発見するのです。
なぜ高いエネルギーを持つアルファ粒子が、薄っぺらい金箔で跳ね返るのか? これは紙の壁に大砲を打ち込んだら、そのままこちらへ跳ね返されたというくらい衝撃的な現象でした。
ラザフォードはこの原因が原子の構造にあると考えました。そして、原子の中身が正電荷の大きな核を中心に電子が惑星のように軌道を描いて回っているという原子核モデルを思いつくのです。
アルファ粒子は正電荷の粒子です。アルファ粒子が極稀に跳ね返るのは正電荷の原子核にぶつかったためで、たまに散乱を起こすのは、原子核の周りに浮かぶ電子の極近距離を通って影響を受けたためと考えたのです。
このときラザフォードの考えた原子核モデルは厳密には正しくないのですが、現代の私達が原子を思い浮かべるイメージの原型になりました。このモデルは、正確では無いにも関わらず、カッコいいので今でもアメリカ原子力委員会の記章になっています。

しかし、このモデルは発表当時は真面目に受け取られませんでした。なぜなら古典物理学の理論では、このモデルは成立しないからです。
荷電粒子が高速で運動した場合、そこからは電磁波が放射され、電子はたちまちエネルギーを失います。これはマクスウェルの電磁気学から明らかにされている事実です。
そうなると電子は軌道を描いて惑星のように回り続けることはできず、たちまち原子核に墜落してしまいます。
ラザフォードは実験結果からこれがかなり正しい原子の姿だと考えていましたが、本人を含めて当時は誰もそんな原子核が現実に成立するとは信じることができませんでした。
こうした中、ラザフォードの研究室に新たなメンバーとして加わったのが、量子力学の最重要人物ニールス・ボーアです。
当時ボーアはJ・J・トムソンの研究室に所属していましたが、知り合いにラザフォードを紹介されてその人柄に惚れ込み、ラザフォードの研究室へと移籍してきました。

ボーアは、ラザフォードの考えた原子核モデルはかなり現実に近いと考えていました。そして、原子核に電子が落ちないようにするためにはどうしたら良いかを考えはじめました。
そこでボーアが採用したのが、電子の軌道の量子化でした。電子は自由にどんな軌道でも回れるわけではなく、決まったエネルギー準位の軌道だけを回っていて、その軌道にあるときはエネルギー放射を行わないと仮定したのです。
これは実際はどうあれ、まずは実験結果と一致した法則を作り出すという、プランクと同様の手法でした。
こうした理論を模索する中で、ボーアはいくつかの重要な研究に出会います。
その1つが、当時物理学者たちの間で謎となっていた元素の線スペクトルの問題でした。
化学の分野に、金属を燃やしたとき元素に応じて炎の色が変わる炎色反応という現象があります。これは昔から知られているものでしたが、19世紀になると、この炎が放つ光のスペクトルに特定の線が入るということが知られるようになります。
元素によってこの線のパターンは決まっていました。いわば元素ごとに持つ光の指紋だったのです。そのため線スペクトルは、現代では天文学において、遥か遠方の天体の構成元素を知るために利用されています。
しかし当時は謎の現象でした。
そんな中、数学者のヨハン・バルマーは実験データからこの線スペクトルの出現する波長を予測する方程式を見つけ出します。ただ、線スペクトルが現れる理由はわかっておらず、なぜバルマーの式が線スペクトルを予測できるのか誰にもわかりませんでした。
ただし、ボーア以外は。
彼はバルマーの式を見て、これが電子の軌道に関係しているということに気づきます。
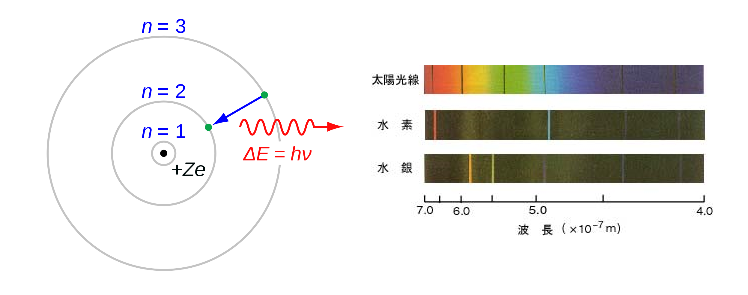
ボーアは、線スペクトルが「原子内で電子が軌道を飛躍した際に放射したエネルギー」なのだと考えました。
原子内で決まったエネルギー量の軌道を回る電子は、外部から熱エネルギーなどを受けた場合、エネルギー量の高い軌道へ移動します。しかし、電子はすぐにそのエネルギーを放出して安定した最低エネルギー状態の軌道へ戻ろうとします。
この放出されたエネルギーが、光の筋となって線スペクトルに現れるのです。ボーアの計算したところ、それは軌道ごとのエネルギー差と見事に一致しました。
そして、このとき放出されるエネルギーも、やはりプランクが発見したhνという量子で導かれました。
こうしてラザフォードの原子モデルの問題も、プランクの量子仮説によって解消され、ボーアによる新しい原子モデルが確立されるのです。
ボーアのこの仕事は世界で高く評価され、彼は祖国デンマークのコペンハーゲンに自らの研究所を設立することになります。
それは後に、量子力学研究の重要拠点となり、コペンハーゲン学派と呼ばれることになります。

研究所設立の翌年、1922年、ボーアは原子物理学におけるこれらの功績によってノーベル物理学賞を受賞します。
量子力学の世界は、こうして少しずつ開拓されていきました。しかし、この時点では、まだプランク定数で現される量子が一体なんなのか? 単なる計算の都合なのか、誰も説明することはできなかったのです。
記事内容に一部誤りがあったため、修正して再送しております。
【誤】波長が長くなると→【正】波長が短くなると




























![【カンタン!たのしい!水の生きもの砂絵セット】 知育玩具のシルバーバック 幼稚園 小学校 入園 入学 お祝い プレゼント 準備 ([バラエティ])](https://m.media-amazon.com/images/I/515gZ4F-QYL._SL500_.jpg)

![[GOHHME] 時計バンド ユニバーサル 時計ベルト 18mm 20mm 22mmシリコンバンド ゴム腕時計バンド 防水時計替えベルト 腕時計バンド18ミリ 20ミリ 22ミリQuick Release スマートウォッチバンド ベルト 防水 交換ベルト 替えバンド スポーツループ 軽量 通気性 調整簡単 (20mm, ブラック)](https://m.media-amazon.com/images/I/31nYWEhwbFL._SL500_.jpg)