蛍の光が生物学の未来を照らす

現在の生物学は、細胞の動きや形を調べるために、さまざまな方法で細胞を光らせています。
特にクラゲから発見された蛍光タンパク質(FP)は革命的な存在であり、世界中の生物学の研究室に常備されるまで普及しました。
(※2008年のノーベル賞は緑色の蛍光タンパク質(GFP)の発見にたずさわった、日本人を含む3名に送られました)
ただ既存の蛍光タンパク質を観察可能にするには特定波長の光(レーザー)を蛍光タンパク質に供給し続ける必要がありました。
また蛍光の強さも限定的であり、細胞がどのように光っているかを調べるには、解剖して臓器を摘出する必要がありました。
そこで近年になり「蛍の発光遺伝子」をマウスに組み込むことで、生物発光を大幅に強化する方法が提案されています。
蛍はルシフェリンという発光基質をルシフェラーゼという発光酵素の助けで光らせています。
やや強引な例でたとえるならば、発光基質のルシフェリンはロウソクで発光酵素のルシフェラーゼは火打石となるでしょう。
(※正確にはルシフェリンはルシフェラーゼの働きによって高エネルギーのオキシルシフェリンになり発光します。上のたとえでは、発光するのはあくまで酸素を取り込んだルシフェリンの代謝物という意味でロウソクに例えました)
特にオリンパス株式会社の研究グループが沖縄に生息する蛍から発見したルシフェラーゼは有望であり、既存の北米産の蛍のルシフェラーゼに比べて4~10倍も明るく黄色の光を発光させることが可能でした。
一方、蛍の発光システムを人工的に再現する研究も進んでおり、理化学研究所では人工基質AkaLumine-HCLと人工酵素Akalucを組み合わせることで、発光効率が従来の100~1000倍で赤く輝く人工生物発光システムAkaBLIを開発しました。
実験にあたってはまず、沖縄の蛍に由来するルシフェラーゼと人工酵素Akalucをそれぞれマウスに組み込んだ系統が作成されました。
たとえで表現するなら、光らせる前準備として、沖縄産の火打石と人工の火打石の設計図を別々のマウスの遺伝子に組み込んだ形となります。
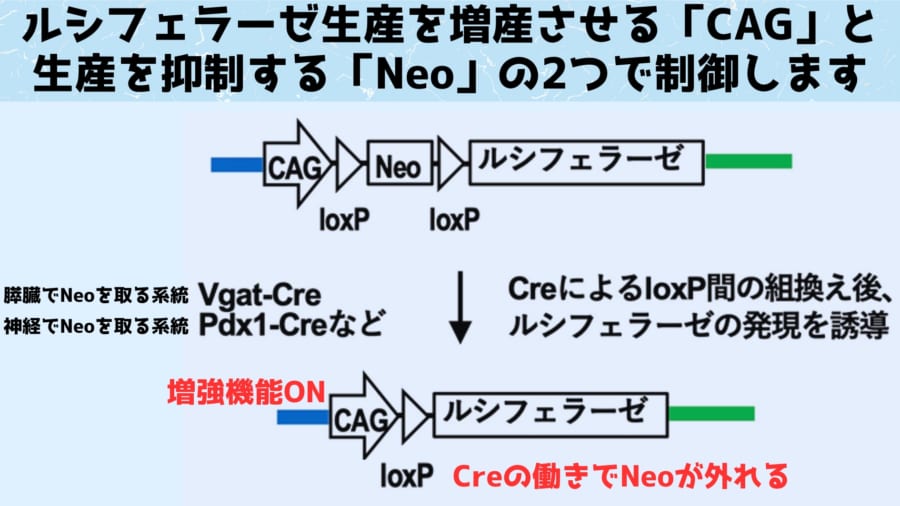
遺伝子操作が終わると、次に研究者たちは発光基質(ロウソク役)であるルシフェリンやAkaLumine-HCLをマウスの体内に注射しました。

すると全身で発光酵素(火打石役)を生産するように遺伝子操作したマウスたちの場合、発光基質(ロウソク役)の注射によって全身が光り輝き、完全な暗闇でも周囲がみえるようになりました。
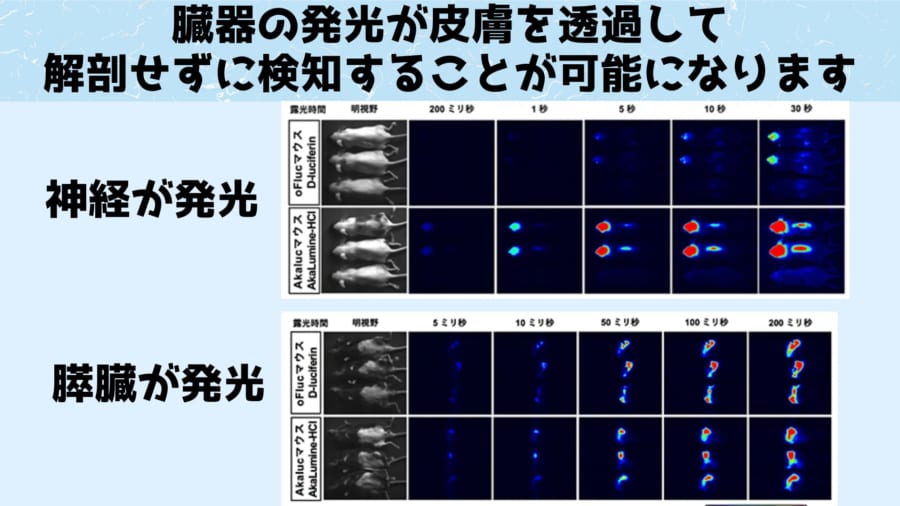
また膵臓だけあるいは神経だけで発光酵素(火打石役)を生産させたマウスに発光基質(ロウソク役)を注射すると、それぞれの臓器から強力な光が内部から皮膚を通して漏れ出し、民生品のデジタルカメラでも検知することが可能になりました。
この結果は、マウスが生きた状態のまま、リアルタイムで臓器の様子を調べられることを示しています。
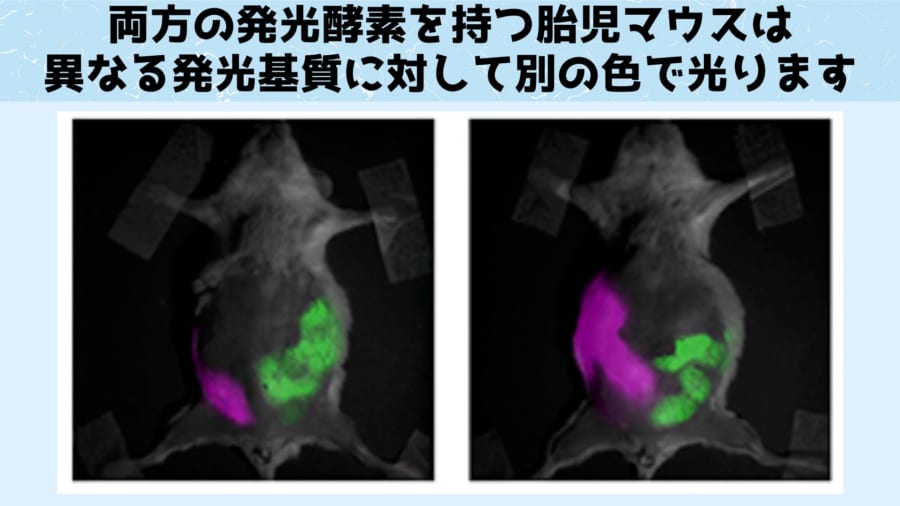
さらに2種類の発光酵素を両方生産するマウスの胎児に対して、一方にルシフェリンのみ、もう一方にAkaLumine-HCLのみを与えた場合、与えられた発光基質の違いにより、一方が黄色でもう一方が赤色と別の色に光らせることが可能になりました。
研究者たちは今後、さまざまな種類の「光る細胞」を作り出し、他の個体に移植することができれば、移植された細胞が体内でどのように動くかを、動物が生きた状態で観察できると述べています。
また異なる色で発光する2つの細胞を追跡することで、細胞同士の競合関係や協調関係を生体内部で追跡できるようになるでしょう。
既存の弱い光しか発しない仕組みでは、細胞の動きを追跡するには解剖を繰り返すしかなく、さらに生物学的に死んだ臓器が、実験結果に偏りを与える可能性も排除しきれませんでした。
研究者たちは開発された技術は他にも、がん細胞と免疫細胞の関係を理解するなど、今後の生物学実験に大いに役立つと述べています。
もしこの技術が発展し、3次元的にも鮮明なイメージングが行われるようになれば、動物実験において解剖を行う必要性が大幅に低下するかもしれません。





























![大人のさらさ 洗濯洗剤 ジェル 1900g シルクエッセンス効果で高保湿 ホワイトティー&フローラルの香り 詰め替え [大容量]](https://m.media-amazon.com/images/I/41G92luj2YL._SL500_.jpg)


![[コロンブス] キレイな状態をキープ アメダス 撥水・防水・防汚スプレー420mL](https://m.media-amazon.com/images/I/31-OcmTs2LL._SL500_.jpg)