サルモネラは生存を有利にするため腸の栄養環境を操作していた
サルモネラは主に大腸で増殖しますが、増殖場所ではない小腸にも侵入することがわかっていました。
そのため、バウムラー氏らの研究チームは、マウスを使ってサルモネラがどのように小腸と大腸の栄養素バランスを変化させるのか追跡しました。
最初に、マウスに通常のサルモネラ(野生型、WT)とT3SS-1、T3SS-2が機能しない無毒性のサルモネラ(invA spiB変異体)を感染させ、大腸や血液中のアミノ酸濃度を調べました。
その結果、サルモネラの毒性因子が小腸の炎症を引き起こし、アミノ酸の吸収不良を招いているとわかりました。
病原体の細胞内でアミノ酸の脱炭酸が行われると、水素イオン(H+)を消費するためpHが上昇(アルカリ化)し、SCFAによる細胞内の酸化に対抗できるため、本来、小腸で吸収されるべきアミノ酸が炎症により吸収されず大腸に多く存在すると、病原体によって有利になると推測されます。
サルモネラの場合、サルモネラの細胞内でリジンとオルニチンというアミノ酸を脱炭酸し、カダベリンとプトレッシンという物質を生成し、細胞内の水素イオン(H+)と一緒に細胞外(宿主の大腸内)に排出することでSCFAによる細胞内酸化を抑制していると考えられました。
実際に実験データでサルモネラ感染後にマウスの大腸内でカダベリンとプトレッシンの濃度が上昇していたことから、研究者らはリジンとオルニチンに着目しました。
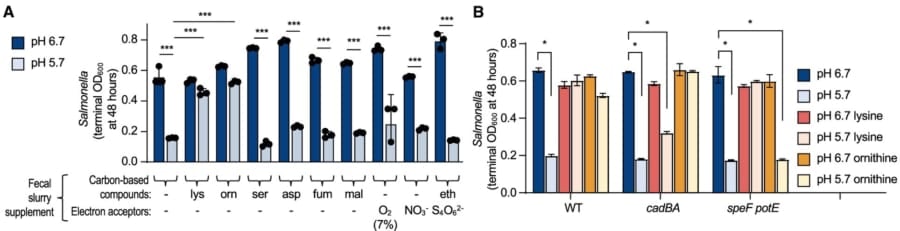
そこで、マウスの糞を使って腸内環境を再現した培地をpH6.7とpH5.7に調整してSCFAを加え、そこにリジン、オルニチンまたはサルモネラ増殖に関与している物質(L-アスパラギン酸、フマル酸、リンゴ酸、酸素、硝酸、テトラチオネートとエタノールアミンのいずれか)を添加した状態で、通常のサルモネラを培養しました。
すると、pH5.7の酸性環境ではリジンとオルニチンのみでサルモネラの増殖がみられました。
さらに、p H6.7、5.7に調整した培地にSCFAのみ、SCFAとリジンまたはオルニチンを添加し、通常のサルモネラ、リジンの脱炭酸で生成されたカダベリンを排出できないcadBA変異体、オルニチンの脱炭酸で生成されたプトレッシンを排出できないspeF potE変異体を培養しました。
その結果、pH5.7の環境だと、cadBA変異体はリジン添加培地で増殖できず、speF potE変異体はオルニチン添加培地で増殖できませんでした。
つまり、サルモネラがリジンまたはオルニチンの脱炭酸によって、SCFAによる増殖阻害を回避していることが証明されたのです。
以上の研究結果から、サルモネラは小腸で炎症を起こし、アミノ酸の吸収を妨げることによって、大腸にアミノ酸が豊富に存在する状態を作り出し、リジンやオルニチンを脱炭酸してpHを調整し、SCFAの防御機構から逃れながら増殖することが明らかになりました。
つまり、サルモネラは自らの生存を有利にするため、大腸内の栄養環境条件を戦略的に操作していたのです。
この新たな知見により、クローン病や潰瘍性大腸炎など炎症性腸疾患、腸内感染症の治療法あるいは予防法の進展が期待されます。
病原体の感染メカニズムについて研究が進めば、腸内細菌を整えるための食事計画など「腸活」にも応用されるかもしれませんね。




























![大人のさらさ 洗濯洗剤 ジェル 1900g シルクエッセンス効果で高保湿 ホワイトティー&フローラルの香り 詰め替え [大容量]](https://m.media-amazon.com/images/I/41G92luj2YL._SL500_.jpg)


![[コロンブス] キレイな状態をキープ アメダス 撥水・防水・防汚スプレー420mL](https://m.media-amazon.com/images/I/31-OcmTs2LL._SL500_.jpg)




![エレコム スマホ 防水ケース お風呂 IPX8 水深10m 吸盤付き [ iPhone 16e / 16シリーズ / 15シリーズ / 14シリーズ /SE3 など、6.9インチ以下のスマートフォン対応] ホワイト P-WPSB04WH](https://m.media-amazon.com/images/I/31kbvYgtI7L._SL500_.jpg)























病原体がここまで計算されているとは思いませんでした。このように適応しながら、現代まで絶滅せずに生き続けているのですね。
我々はコロナで苦い経験をしたばかりですが、病原体やウイルスを侮らないようにしましょう。興味深い記事をありがとうございました。