うだるような暑さに寝苦しい日々が続く今日このごろ。今年も「花火」の季節がやってきました。
色鮮やかな光を放ち、私たちを楽しませてくれる花火ですが、どういった仕組みで花火の「色が異なる」のかを説明できますか?
なんとなく分かっている人も多いかと思いますが、海外Youtubeチャンネル “Skunk Bear” が動画で分かりやすく説明してくれているので、一緒に復習してみましょう。
まずは最もシンプルな「白い光」から。これは「白熱(incandescent)」の光を利用したものです。
「白熱電球」を思い出してください。何かが非常に高温まで熱せられると、その物質を構成している原子が振動を始め、摩擦を起こし、「光」といった形でエネルギーを放出します。
光の色は温度の上昇とともに変化し、最も高い温度を示す色が「白」になります。
つまり花火の「白」は、単に非常に高温なアルミニウムなどの金属片であることがわかります。
しかし、この「白熱光の色」を温度でコントロールすることは非常に困難です。
そこで利用されるのが、金属による炎色反応の違いを利用した「発光(luminescence)」です。
「発光(luminescence)」によって「黄色の光」を作りたい場合は…
「ナトリウム(ソジウム)」を用います。いわゆる食卓塩ですね。
塩をひとすくいして炎にさらせば、鮮やかな「黄色い炎」が姿を現します。
ナトリウムの原子が加熱されると、その周りの「電子」が熱のエネルギーを吸収して、低いエネルギー状態から高いエネルギー状態へとジャンプします。
そしてそこから元の低いエネルギー状態に戻る時に、電子は小さな光の塊である「光子(photon)」を発射します。
この「エネルギーの差」によって発せられる光子のエネルギーが、元素によって異なり、それがナトリウムの場合「黄色の波長」を作り出しているということです。
次の色をみてみましょう。
テレビのスクリーンに用いられる「ストロンチウム」は…
「赤い光」をもたらします。
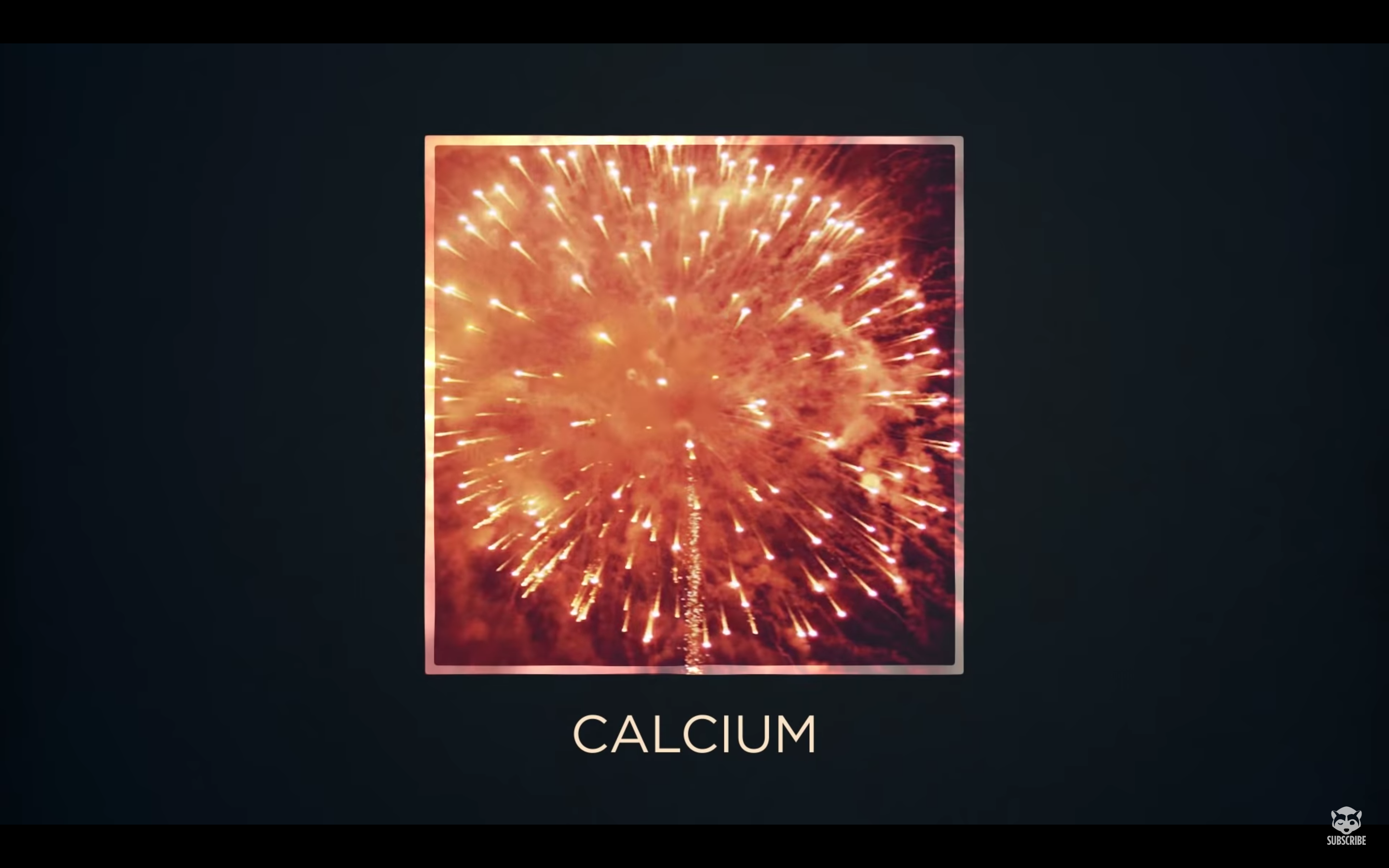
骨の材料「カルシウム」は…
「オレンジ色」に。
健康診断の嫌われ者「バリウム」は…
「緑色」になります。
「青色」に関しては、かつて「ヒ素」が使用されていました。
しかし、ヒ素を空にバラまくのはやはり良くないといったことになり…
代わりに「銅」が使われるようになりました。
それらの化学物質は、粉の状態で花火玉の中に混ぜられます。
あとは導火線に火をつけるだけで…
It’s Show Time!!
どうでしたか?色の違いの仕組みを理解できたでしょうか?
ただし化学は決してロマンチックではないため、デートでこのうんちくを話すかどうかは、慎重な判断が要求されそうです。


















































![[WILL CLENS] シューズパウダー 日本製 無香料 シューケアキット 靴 消臭 パウダー (1本)](https://m.media-amazon.com/images/I/41m8Ig2XigL._SL500_.jpg)

![[W.P.S.] 防水スプレー 除菌 抗菌 防汚 機能付き 大容量420ml 日本製](https://m.media-amazon.com/images/I/41aHfy9uuZL._SL500_.jpg)
![よーく聞いてね!3つのヒントで学ぶ!どうぶつカード ([バラエティ])](https://m.media-amazon.com/images/I/51zT3OcliFL._SL500_.jpg)



























